题目内容
【题目】固体硝酸盐加热易分解且产物较复杂。某学习小组以Mg(NO3)2为研究对象,拟通过实验探究其热分解的产物。
(1)实验前,小组对Mg(NO3)2分解产物的组成提出如下4种猜想:
甲:MgO、NO2、O2乙:Mg(NO2)2、NO2、O2
丙:Mg3N2、O2丁:MgO、NO2、N2
不需要实验验证就认定猜想丁不成立,理由是___________________________。
(2)实验过程
查阅资料得知2NO2+2NaOH=NaNO3+NaNO2+H2O,针对甲、乙、丙猜想,设计如下图所示的实验装置(图中加热、夹持仪器等均省略):

①检查如上装置气密性应如何操作______________________。
②经检验装置气密性良好,称取7.4 g Mg(NO3)2固体置于硬质玻璃管A中,并连接好上图装置。在用酒精灯给硬质玻璃管A加热前,先进行的操作是__________。
③观察到A中有红棕色气体出现。
④待样品完全分解,A 装置冷却至室温、称量,测得剩余固体的质量为2.0g,通过计算确定该剩余固体的成分是__________(填化学式)。
(3)实验结果分析讨论
①某同学提出:取A中少量剩余固体于试管中,加入适量水,如未见明显现象,也能直接排除甲、乙、丙中的一种猜想,判定依据是__________(用化学方程式表示)。
②根据以上分析可初步确认猜想_______(填甲、乙、丙)是正确的。
③为验证产物中的O2,学习小组对实验装置进行了如下图的改进,其中装置B的作用是__________,装置C的作用是_________,若D中出现________现象,说明产物中有O2。
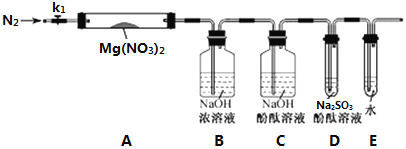
④小组同学用改进后的装置重新实验,却发现D 中无明显现象,但小组讨论认定分解产物中仍有O2存在,未检测到的原因是_______(用化学反应方程式表示)。
【答案】 不符合氧化还原反应规律(元素的化合价只有降低没有升高) 关闭k1,打开k2,将k2右侧连接导气管,并浸入水槽中,用手或热毛巾微热硬质玻璃管(或洗气瓶B),若导管口有气泡逸出,冷却后导管口形成一段水柱,表明装置气密性良好 通入氮气,排净空气 MgO Mg3N2+6H2O=3Mg(OH)2 +2NH3 甲 吸收产物中的NO2 验证NO2是否除尽 红色变浅或褪色 4NO2+O2+2H2O=4HNO3(4NO2+O2+4NaOH=4NaNO3+2H2O)
【解析】试题分析:(1)Mg(NO3)2分解过程中发生了氧化还原反应,元素化合价既要有升高又要有降低;(2)①根据气体压强原理检验装置气密性;②甲乙丙都有氧气生成,而空气中也存在氧气,所以必须把空气中的氧气除去,以防带来干扰;④根据镁元素守恒,计算剩余固体的摩尔质量;(3)①Mg3N2与水反应生成氨气;②根据以上分析一定有氧化镁生成;③根据2NO2+2NaOH=NaNO3+NaNO2+H2O,分析装置B的作用, NO2与水反应生成硝酸,酚酞褪色;D中盛放的溶液是Na2SO3溶液,Na2SO3具有还原性,能被氧气氧化生成Na2SO4。④ B中可发生反应4NO2+O2+4NaOH=4NaNO3+2H2O。
解析:(1)Mg(NO3)2分解过程中发生了氧化还原反应(元素化合价既升高也降低),而丁组中,只有降低的N元素,而没有升高的元素,不符合氧化还原反应的规律;(2)①关闭k1,打开k2,将k2右侧连接导气管,并浸入水槽中,用手或热毛巾微热硬质玻璃管(或洗气瓶B),若导管口有气泡逸出,冷却后导管口形成一段水柱,表明装置气密性良好;②给硬质玻璃管A加热前,先通入氮气,排净空气,防止空气中氧气的干扰;④7.4 g Mg(NO3)2的物质的量是![]() ,根据镁元素守恒,剩余固体的物质的量是0.05mol,则固体的摩尔质量是
,根据镁元素守恒,剩余固体的物质的量是0.05mol,则固体的摩尔质量是![]() ,所以剩余固体是MgO;(3)①Mg3N2与水反应生成氨气,反应方程式是Mg3N2+6H2O=3Mg(OH)2 +2NH3,若没有没明显现象,则不可能是丙;②根据以上分析一定有氧化镁生成,所以甲正确;③根据2NO2+2NaOH=NaNO3+NaNO2+H2O,装置B的作用是吸收产物中的NO2, NO2与水反应生成硝酸,酚酞褪色,C装置的作用是验证NO2是否除尽;D中盛放的溶液是Na2SO3溶液,Na2SO3具有还原性,能被氧气氧化生成Na2SO4,若D中红色变浅或褪色,说明产物中有O2。④ B中可发生反应4NO2+O2+4NaOH=4NaNO3+2H2O,所以D 检测不到氧气。
,所以剩余固体是MgO;(3)①Mg3N2与水反应生成氨气,反应方程式是Mg3N2+6H2O=3Mg(OH)2 +2NH3,若没有没明显现象,则不可能是丙;②根据以上分析一定有氧化镁生成,所以甲正确;③根据2NO2+2NaOH=NaNO3+NaNO2+H2O,装置B的作用是吸收产物中的NO2, NO2与水反应生成硝酸,酚酞褪色,C装置的作用是验证NO2是否除尽;D中盛放的溶液是Na2SO3溶液,Na2SO3具有还原性,能被氧气氧化生成Na2SO4,若D中红色变浅或褪色,说明产物中有O2。④ B中可发生反应4NO2+O2+4NaOH=4NaNO3+2H2O,所以D 检测不到氧气。

【题目】氮氧化物、二氧化硫是造成大气污染的主要物质,某科研小组进行如下研究。
(1)已知:
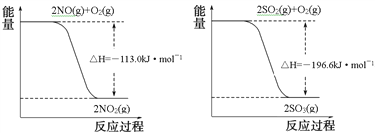
写出SO2(g)与NO2(g)反应生成SO3(g)和NO(g)的热化学方程式___________________。
(2)向容积为1L密闭容器中分别充入0.10molNO2和0.15mol SO2,在不同温度下测定同一时刻NO2的转化率,结果如图所示。

①a、c两点反应速率大小关系:υ(a)________υ(c)。(填“>”、“<”或“=”)
②温度为T2时从反应开始经过2min达到b点,用SO3表示这段时间的反应速率为_____________,此温度下该反应的平衡常数为____________,若在此温度下,保持容器的容积不变,再向容器中充入0.20molNO2和0.30mol SO2,NO2的转化率_________________。(填“增大”、“减小”或“不变”)
③NO2的转化率随温度升高先增大后减小的原因是: ____________________。
(3)常温下用NaOH溶液吸收SO2,在吸收过程中,溶液pH随n(SO32―)∶n(HSO3―)变化关系如下表:
n(SO32―)∶n(HSO3―) | 91∶9 | 1∶1 | 9∶91 |
pH | 8.2 | 7.2 | 6.2 |
①当吸收液呈中性时,溶液中离子浓度由大到小排列顺序为______________。
②当向NaOH溶液中通入足量的SO2时,得到NaHSO3溶液,在pH为4~7之间电解,硫元素在阴极上被还原为Na2S2O4,这是电化学脱硫技术之一,写出该阴极的电极反应式_____________。
【题目】工业上用含有铝、铁、铜的废弃合金为主要原料制取硫酸铝溶液、硝酸铜晶体和无水氯化铁,其生产流程如图所示。
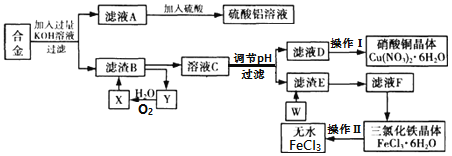
已知:
沉淀物 | Fe(OH)3 | Cu(OH)2 |
开始沉淀的pH | 1.9 | 4.7 |
沉淀完全的pH | 3.2 | 6.7 |
(1)在滤液A中直接加入硫酸后所得到的硫酸铝溶液中除含少量硫酸外,还一定含有的杂质是______(填化学式)。
(2)请设计一个更合理的实验方案由滤液A制备纯净的硫酸铝溶液,写出相关的两个离子方程式______、______。
(3)将溶液C调节pH,pH的范围是______。
A.3.2≤pH≤4.7 B.3.2≤pH<4.7 C.3.2<pH<4.7D.3.2<pH≤4.7
(4)要制得更纯的Cu(NO3)2·6H2O晶体,可进行的操作是______(填操作名称)。
(5)操作Ⅱ的具体操作是______。