题目内容
【题目】催化还原CO2是解决温室效应及能源问题的重要手段之一,研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1=-53.7kJmol-1 I
CH3OH(g)+H2O(g) △H1=-53.7kJmol-1 I
CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H2 II
CO(g)+H2O(g) △H2 II
某实验室控制CO2和H2初始投料比为1︰2.2,在相同压强下,经过相同反应时间测得如下实验数据:
T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
543 | Cat.1 | 12.3 | 42.3 |
543 | Cat.2 | 10.9 | 72.7 |
553 | Cat.1 | 15.3 | 39.1 |
553 | Cat.2 | 12.0 | 71.6 |
[备注]Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比
已知:①CO和H2的标准燃烧热分别为-283.0kJmol-1和-285.8kJmol-1。
②H2O(l)=H2O(g) △H3=+44.0kJmol-1
请回答(不考虑温度对△H的影响):
(1)反应I的平衡常数表达式K=______;反应II的△H2=______kJmol-1.
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有__________。
A.使用催化剂Cat.1 B.使用催化剂Cat.2
C.降低反应温度 D.投料比不变,增加反应物的浓度
E.增大 CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是___________________________。
(4)在如图中分别画出反应I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程-能量”示意图_________。

(5)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在______极,该电极反应式是_________。
【答案】 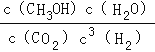 +41.2 CD 表中数据表明此时未达到平衡,不同的催化剂对反应I的催化能力不同,因而在该时刻下对甲醇选择性有影响
+41.2 CD 表中数据表明此时未达到平衡,不同的催化剂对反应I的催化能力不同,因而在该时刻下对甲醇选择性有影响 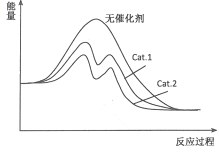 阴 CO2+6H++6e-=CH3OH+H2O
阴 CO2+6H++6e-=CH3OH+H2O
【解析】(1)反应I的平衡常数表达式K=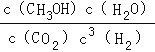 ;由①CO和H2的标准燃烧热分别为-283.0kJmol-1和-285.8kJmol-1以及②H2O(l)=H2O(g) △H3=+44.0kJmol-1,由盖斯定律可得反应II的△H2=-285.8kJmol-1-(-283.0kJmol-1)+44.0kJmol-1=+41.2kJmol-1.
;由①CO和H2的标准燃烧热分别为-283.0kJmol-1和-285.8kJmol-1以及②H2O(l)=H2O(g) △H3=+44.0kJmol-1,由盖斯定律可得反应II的△H2=-285.8kJmol-1-(-283.0kJmol-1)+44.0kJmol-1=+41.2kJmol-1.
(2)因为CO2转化为CH3OH的反应是一个气体分子数减少的放热反应,所以降温或加压可以使该反应的化学平衡向正反应方向移动。有利于提高CO2转化为CH3OH平衡转化率的措施有降低反应温度或在投料比不变的条件下增加反应物的浓度(即增大压强),选CD。
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是: 表中数据表明此时未达到平衡,不同的催化剂对反应I的催化能力不同,因而在该时刻下对甲醇选择性有影响。
(4)加入催化剂可以降低反应的活化能。由表中数据可知,Cat.2的催化效率比Cat.1高,所以反应I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程-能量”示意图为: 。
。
(5)电解过程中,阳极上发生氧化反应,阴极上发生还原反应。由题意知,CO2在酸性水溶液中通过电解被二氧化碳还原为甲醇,则生成甲醇的反应发生在阴极上,该电极反应式是CO2+6H++6e-=CH3OH+H2O。

【题目】氮氧化物、二氧化硫是造成大气污染的主要物质,某科研小组进行如下研究。
(1)已知:
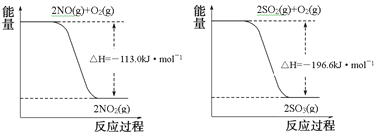
写出SO2(g)与NO2(g)反应生成SO3(g)和NO(g)的热化学方程式___________________。
(2)向容积为1L密闭容器中分别充入0.10molNO2和0.15mol SO2,在不同温度下测定同一时刻NO2的转化率,结果如图所示。

①a、c两点反应速率大小关系:υ(a)________υ(c)。(填“>”、“<”或“=”)
②温度为T2时从反应开始经过2min达到b点,用SO3表示这段时间的反应速率为_____________,此温度下该反应的平衡常数为____________,若在此温度下,保持容器的容积不变,再向容器中充入0.20molNO2和0.30mol SO2,NO2的转化率_________________。(填“增大”、“减小”或“不变”)
③NO2的转化率随温度升高先增大后减小的原因是: ____________________。
(3)常温下用NaOH溶液吸收SO2,在吸收过程中,溶液pH随n(SO32―)∶n(HSO3―)变化关系如下表:
n(SO32―)∶n(HSO3―) | 91∶9 | 1∶1 | 9∶91 |
pH | 8.2 | 7.2 | 6.2 |
①当吸收液呈中性时,溶液中离子浓度由大到小排列顺序为______________。
②当向NaOH溶液中通入足量的SO2时,得到NaHSO3溶液,在pH为4~7之间电解,硫元素在阴极上被还原为Na2S2O4,这是电化学脱硫技术之一,写出该阴极的电极反应式_____________。
【题目】工业上用含有铝、铁、铜的废弃合金为主要原料制取硫酸铝溶液、硝酸铜晶体和无水氯化铁,其生产流程如图所示。

已知:
沉淀物 | Fe(OH)3 | Cu(OH)2 |
开始沉淀的pH | 1.9 | 4.7 |
沉淀完全的pH | 3.2 | 6.7 |
(1)在滤液A中直接加入硫酸后所得到的硫酸铝溶液中除含少量硫酸外,还一定含有的杂质是______(填化学式)。
(2)请设计一个更合理的实验方案由滤液A制备纯净的硫酸铝溶液,写出相关的两个离子方程式______、______。
(3)将溶液C调节pH,pH的范围是______。
A.3.2≤pH≤4.7 B.3.2≤pH<4.7 C.3.2<pH<4.7D.3.2<pH≤4.7
(4)要制得更纯的Cu(NO3)2·6H2O晶体,可进行的操作是______(填操作名称)。
(5)操作Ⅱ的具体操作是______。