题目内容
【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:
已知H2的燃烧热为285.8kJ·mol-1
N2(g)+2O2(g)=2NO2(g) ΔH=+133kJ·mol-1
H2O(g)=H2O(l) ΔH=-44kJ·mol-1
催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为___。
Ⅱ.脱碳:(1)向2L密闭容器中加入2molCO2和6molH2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l) ΔH<0
CH3OH(l)+H2O(l) ΔH<0
①该反应自发进行的条件是___(填“低温”“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是___(填字母)。
a.混合气体的平均相对分子质量保持不变 b.CO2和H2的体积分数保持不变
c.CO2和H2的转化率相等 d.混合气体的密度保持不变
e.1molCO2生成的同时有3 molH—H键断裂
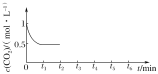
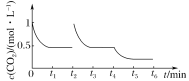
③CO2的浓度随时间(0~t2)变化如图所示,在t2时将容器容积缩小一倍,t3时达到平衡,
t4时降低温度,t5时达到平衡,请画出t2~t6时间段CO2浓度随时间的变化___。
(2)改变温度,使反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH<0中的所有物质都为气态。起始温度、体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:
CH3OH(g)+H2O(g) ΔH<0中的所有物质都为气态。起始温度、体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:
反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
反应Ⅰ: 恒温恒容 | 0min | 2 | 6 | 0 | 0 |
10min | 4.5 | ||||
20min | 1 | ||||
30min | 1 | ||||
反应Ⅱ: 绝热恒容 | 0min | 0 | 0 | 2 | 2 |
①达到平衡时,反应Ⅰ、Ⅱ对比:平衡时CH3OH的浓度c(Ⅰ)___c(Ⅱ)(填“>”“<”或“=”)。
②对反应Ⅰ,前10min内的平均反应速率v(CH3OH)=___。在其他条件不变的情况下,若30 min时只改变温度至T2℃,此时H2的物质的量为3.2mol,则T1___(填“>”“<”或“=”)T2。若30min时只向容器中再充入1 molCO2(g)和1molH2O(g),则平衡___(填“正向”“逆向”或“不”)移动。
(3)利用人工光合作用可将CO2转化为甲酸,反应原理为2CO2+2H2O=2HCOOH+O2,装置如图所示:
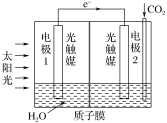
①电极2的电极反应式是____;
②在标准状况下,当电极2室有11.2LCO2反应。理论上电极1室液体质量___(填“增加”或“减少”)___g。
【答案】4H2(g)+2NO2(g)=N2(g)+4H2O(g) ΔH=-1100.2kJ·mol-1 低温 de  < 0.025mol·L-1·min-1 < 不 CO2+2H++2e-=HCOOH 减少 9
< 0.025mol·L-1·min-1 < 不 CO2+2H++2e-=HCOOH 减少 9
【解析】
根据题意可知,本题考查热化学方程式的书写、化学平衡移动、化学反应速率、电化学知识,运用盖斯定律、勒夏特列原理、![]() 、电化学原理分析。
、电化学原理分析。
Ⅰ.H2的燃烧热为285.8kJmol1,则①.2H2(g)+O2(g)=2H2O(l) △H=571.6kJmol1,②.N2(g)+2O2(g)=2NO2(g) △H=+133kJmol1③.H2O(g)=H2O(l) △H=44kJmol1根据盖斯定律①×2②③×4可得:4H2(g)+2NO2(g)=N2(g)+4H2O(g),则:△H=2×(571.6kJmol1)133kJmol14×(44kJmol1) = 1100.2kJmol1,故反应热化学方程式为:4H2(g)+2NO2(g)=N2(g)+4H2O(g) △H=1100.2kJmol1,
故答案为:4H2(g)+2NO2(g)=N2(g)+4H2O(g) △H=1100.2kJmol1;
Ⅱ. (1)①CO2(g)+3H2(g)═CH3OH(l)+H2O(l),熵变△S<0,则反应焓变△H<0,低温下满足△HT△S<0
故答案为:低温;
②a.甲醇、水为液体,CO2、H2的起始物质的量之比为1:3,反应按物质的量1:3反应,故混合气体中CO2、H2的起始物质的量之比为1:3,平均摩尔质量数值或平均相对分子质量始终保持不变,无法判断是平衡状态,故a错误;
b.由a中分析,可知CO2和H2的体积分数数值始终保持不变,无法判断是平衡状态,故b错误;
c.由a中分析,可知CO2和H2的转化率始终相等,无法判断是平衡状态,故c错误;
d.容器容积不变,混合气体质量减小,随反应进行混合气体密度减小,当混合气体的密度不变,反应到达平衡,故d正确;
e.1molCO2生成的同时有3molHH键断裂,而1molCO2生成的同时生成3molHH键,氢气的生成速率与消耗速率相等,反应到达平衡,故e正确,
故答案为:de;
③t2时CO2浓度为0.5mol/L,则氢气浓度变化量为(1mol/L0.5mol/L)×3=1.5mol/L,氢气平衡浓度为![]() 1.5mol/L=1.5mol/L,则该温度下平衡常数
1.5mol/L=1.5mol/L,则该温度下平衡常数![]() ,在t2时将容器容积缩小一倍,瞬间CO2浓度变为1mol/L,压强增大,平衡向正反应方向移动,t3时达到平衡时,等效为开始体积缩小一倍到达的平衡,设此时CO2浓度为xmol/L,则:
,在t2时将容器容积缩小一倍,瞬间CO2浓度变为1mol/L,压强增大,平衡向正反应方向移动,t3时达到平衡时,等效为开始体积缩小一倍到达的平衡,设此时CO2浓度为xmol/L,则:
CO2(g)+3H2(g)CH3OH(l)+H2O(l)
开始(mol/L): 2 6
转化(mol/L): 2x 63x
平衡(mol/L) :x 3x
则![]() ,解得x=0.5,
,解得x=0.5,
t3时达到平衡时CO2浓度为0.5mol/L,t4时降低温度,瞬间CO2浓度不变,正反应为放热反应,而后平衡向正反应移动,CO2浓度减小,画出t2t6CO2的浓度随时间的变化如图:
 。
。
故答案为:  ;
;
故答案为:<;
②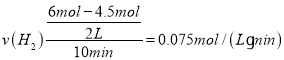 ,速率之比等于化学计量数之比,v(CH3OH)=
,速率之比等于化学计量数之比,v(CH3OH)=![]() v(H2)=0.025mol/(Lmin);20min时,转化的CO2为2mol1mol=1mol,则生成的CH3OH为1mol,而30min时CH3OH为1mol,故20min时已达平衡,
v(H2)=0.025mol/(Lmin);20min时,转化的CO2为2mol1mol=1mol,则生成的CH3OH为1mol,而30min时CH3OH为1mol,故20min时已达平衡,
CO2(g)+3H2(g)CH3OH(g)+H2O(g)
开始(mol/L): 2 6 0 0
转化(mol/L): 1 3 1 1
平衡(mol/L): 1 3 1 1
故平衡常数 ,
,
平衡时氢气为6mol1mol×3=3mol,氢气平衡浓度为![]() ,在其他条件不变的情况下,若30min时只改变温度T2℃,此时H2的物质的量为3.2mol,平衡逆向移动,氢气浓度增大,由于正反应为放热反应,可以升高温度,即T1<T2;对反应Ⅰ,若30min时只向容器中再充入1molCO2(g)和1molH2O(g),此时浓度商
,在其他条件不变的情况下,若30min时只改变温度T2℃,此时H2的物质的量为3.2mol,平衡逆向移动,氢气浓度增大,由于正反应为放热反应,可以升高温度,即T1<T2;对反应Ⅰ,若30min时只向容器中再充入1molCO2(g)和1molH2O(g),此时浓度商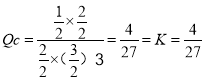 ,则平衡不移动;
,则平衡不移动;
故答案为:0.025mol/(Lmin);<;不;
(3)①电极2是正极,正极上二氧化碳得电子和氢离子反应生成HCOOH,电极反应式为CO2+2H++2e=HCOOH,
故答案为:CO2+2H++2e=HCOOH;
②电极1式为负极,发生的电极反应式为2H2O4e=4H++O2↑,理论上随着当电极2室有11.2L CO2反应,二氧化碳的物质的量为![]() ,转移电子为0.5mol×2=1mol,电极1室参加反应的水的质量为18g/mol×
,转移电子为0.5mol×2=1mol,电极1室参加反应的水的质量为18g/mol×![]() =9g,即电极1室理论减小液体质量为9g,
=9g,即电极1室理论减小液体质量为9g,
故答案为:减小;9。