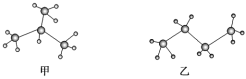题目内容
【题目】如图所示,甲池的总反应式为:N2H4+O2 =N2+H2O,下列关于该电池工作时的说法正确的是( )
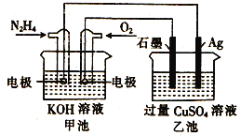
A.该装置工作时,甲池中溶液的pH增大
B.乙池中负极反应为2Ag-2e-+SO42-=Ag2SO4
C.甲池正极反应O2+4e-+4H+=2H2O
D.当甲池中消耗0.05molN2H4时,乙池中理论上最多产生6.4g固体
【答案】D
【解析】
甲池能自发的发生氧化还原反应而作原电池,通入肼的电极为负极,通入氧气的电极为正极,负极反应为N2H4-4e-+4OH-=N2+4H2O,正极反应为O2+4e-+2H2O=4OH-,乙池为电解池,阴极电极反应为 Cu2++2e-=Cu、阳极反应为4OH--4e-=2H2O+O2↑,据此分析解答。
A. 甲装置工作时,总反应为N2H4+O2 =N2+H2O,有水生成,甲池中氢氧化钾浓度减小,溶液的pH降低,故A错误;
B. 乙池是电解池,银电极为阴极,阴极反应为Cu2++2e-=Cu,故B错误;
C. 甲池是原电池,正极通入氧气,正极反应是O2+4e-+2H2O=4OH-,故C错误;
D. 当甲池中消耗0.05molN2H4时转移电子0.2mol,乙池中阴极最多产生铜![]() =6.4g,故D正确;
=6.4g,故D正确;
选D。

【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:
已知H2的燃烧热为285.8kJ·mol-1
N2(g)+2O2(g)=2NO2(g) ΔH=+133kJ·mol-1
H2O(g)=H2O(l) ΔH=-44kJ·mol-1
催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为___。
Ⅱ.脱碳:(1)向2L密闭容器中加入2molCO2和6molH2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l) ΔH<0
CH3OH(l)+H2O(l) ΔH<0
①该反应自发进行的条件是___(填“低温”“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是___(填字母)。
a.混合气体的平均相对分子质量保持不变 b.CO2和H2的体积分数保持不变
c.CO2和H2的转化率相等 d.混合气体的密度保持不变
e.1molCO2生成的同时有3 molH—H键断裂
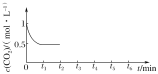
③CO2的浓度随时间(0~t2)变化如图所示,在t2时将容器容积缩小一倍,t3时达到平衡,
t4时降低温度,t5时达到平衡,请画出t2~t6时间段CO2浓度随时间的变化___。
(2)改变温度,使反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH<0中的所有物质都为气态。起始温度、体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:
CH3OH(g)+H2O(g) ΔH<0中的所有物质都为气态。起始温度、体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:
反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
反应Ⅰ: 恒温恒容 | 0min | 2 | 6 | 0 | 0 |
10min | 4.5 | ||||
20min | 1 | ||||
30min | 1 | ||||
反应Ⅱ: 绝热恒容 | 0min | 0 | 0 | 2 | 2 |
①达到平衡时,反应Ⅰ、Ⅱ对比:平衡时CH3OH的浓度c(Ⅰ)___c(Ⅱ)(填“>”“<”或“=”)。
②对反应Ⅰ,前10min内的平均反应速率v(CH3OH)=___。在其他条件不变的情况下,若30 min时只改变温度至T2℃,此时H2的物质的量为3.2mol,则T1___(填“>”“<”或“=”)T2。若30min时只向容器中再充入1 molCO2(g)和1molH2O(g),则平衡___(填“正向”“逆向”或“不”)移动。
(3)利用人工光合作用可将CO2转化为甲酸,反应原理为2CO2+2H2O=2HCOOH+O2,装置如图所示:
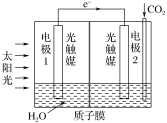
①电极2的电极反应式是____;
②在标准状况下,当电极2室有11.2LCO2反应。理论上电极1室液体质量___(填“增加”或“减少”)___g。