题目内容
9.下列无色溶液中能大量共存的一组离子是( )| A. | H+、Ba2+、ClO-、SO42- | B. | Fe3+、H+、SO42-、I- | ||
| C. | Cu2+、NO3-、HCO3-、OH- | D. | K+、Ba2+、NO3-、Cl- |
分析 无色溶液时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,
A.钡离子与硫酸根离子反应生成硫酸钡沉淀、氢离子与次氯酸根离子生成次氯酸;
B.铁离子具有氧化性,能够氧化碘离子;
C.铜离子为有色离子,且铜离子能够与碳酸氢根离子、氢氧根离子反应,碳酸氢根离子与氢氧根离子反应;
D.四种离子之间不反应,能够大量共存.
解答 解:溶液无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,
A.H+与ClO-,Ba2+与SO42-之间反应,在溶液中不能大量共存,故A错误;
B.Fe3+、I-之间发生氧化还原反应,在溶液中不能大量共存,故B错误;
C.Cu2+为有色离子,且能够与HCO3-、OH-发生反应,HCO3-、OH-之间反应生成碳酸根离子和水,在溶液中不能大量共存,故C错误;
D.K+、Ba2+、NO3-、Cl-之间不发生反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的判断,题目难度中等,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间,能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.下列物质性质的变化规律,与共价键能大小有关的是( )
| A. | F2、Cl2、Br2、I2的熔点、沸点逐渐升高 | |
| B. | Li、Na、K、Rb熔沸点依次减弱 | |
| C. | 金刚石的硬度、熔点、沸点都高于晶体硅 | |
| D. | NaF、NaCl、NaBr、NaI的熔点依次降低 |
20.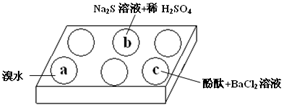 在白色点滴板上进行Na2SO3 的性质实验探究.如图所示,a、b、c三个凹槽中滴有Na2SO3 溶液,再分别滴加下图所示的试剂:
在白色点滴板上进行Na2SO3 的性质实验探究.如图所示,a、b、c三个凹槽中滴有Na2SO3 溶液,再分别滴加下图所示的试剂:
(1)a中实验现象是溴水褪色,该现象可证明Na2SO3具有还原性.
(2)b中发生反应的离子方程式是SO32-+2S2-+6H+=3S↓+3 H2O.
(3)应用化学平衡原理解释c中现象(用化学用语及简单文字表述)在Na2SO3溶液中,SO32-水解显碱性:SO32-+H2O?HSO3-+OH-,所以滴入酚酞后溶液变红;在该溶液中加入BaCl2后,Ba2++SO32-═BaSO3↓(白色),由于c(SO32-)减小,SO32-水解平衡左移,c(OH-)减小,红色褪去.
(4)在用NaOH 溶液吸收SO2 的过程中,往往得到Na2SO3和NaHSO3 的混合溶液,溶液pH 随n(SO32-):n(HSO3-) 变化关系如表:
①当吸收液中n(SO32-):n(HSO3-)=10:1 时,溶液中离子浓度关系正确的是ac(选填编号).
a.c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(OH-)>c(H+)
c.c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+)
②若n(SO32-):n(HSO3-)=3:2,则0.8mol NaOH溶液吸收了标准状况下的SO211.2 L.
 在白色点滴板上进行Na2SO3 的性质实验探究.如图所示,a、b、c三个凹槽中滴有Na2SO3 溶液,再分别滴加下图所示的试剂:
在白色点滴板上进行Na2SO3 的性质实验探究.如图所示,a、b、c三个凹槽中滴有Na2SO3 溶液,再分别滴加下图所示的试剂:(1)a中实验现象是溴水褪色,该现象可证明Na2SO3具有还原性.
(2)b中发生反应的离子方程式是SO32-+2S2-+6H+=3S↓+3 H2O.
(3)应用化学平衡原理解释c中现象(用化学用语及简单文字表述)在Na2SO3溶液中,SO32-水解显碱性:SO32-+H2O?HSO3-+OH-,所以滴入酚酞后溶液变红;在该溶液中加入BaCl2后,Ba2++SO32-═BaSO3↓(白色),由于c(SO32-)减小,SO32-水解平衡左移,c(OH-)减小,红色褪去.
(4)在用NaOH 溶液吸收SO2 的过程中,往往得到Na2SO3和NaHSO3 的混合溶液,溶液pH 随n(SO32-):n(HSO3-) 变化关系如表:
| n(SO3 2-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
a.c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(OH-)>c(H+)
c.c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+)
②若n(SO32-):n(HSO3-)=3:2,则0.8mol NaOH溶液吸收了标准状况下的SO211.2 L.
17.原子序数依次增大的A、B、C、D、E五种非0族元素组成了某化合物M,其中A是元素周期表中原子半径最小的元素,B元素原子最外层p能级比s能级多一个电子,C、D元素同主族且原子序数D为C的二倍,E元素的原子外围电子排布为(n-1)dn+6ns1.下列关于M的说法不正确的是( )
| A. | 若化合物M其原子个数比为14:4:5:1:1,则其化学式为[Cu(NH3)4]SO4•H2O | |
| B. | 若该化合物为配合物,则E离子给出孤对电子 | |
| C. | C元素与D元素形成的一种具有较强还原性的分子的VSEPR模型为平面三角形 | |
| D. | DC42-空间构型为正四面体 |
4.2014年10月8日,诺贝尔化学奖授予了三位超高分辨率荧光显微镜的贡献者,这是迄今人类玻璃显微镜的最高成就,玻璃属于( )
| A. | 纯净物 | B. | 混合物 | C. | 单质 | D. | 化合物 |
1.设NA代表阿伏加德罗常数,下列叙述正确的是( )
| A. | 0.1mol铁在氯气中完全反应失去的电子数为0.2NA | |
| B. | 常温常压下,1L 0.1mol•L-1氯化铝溶液中含有0.3 NA个Cl- | |
| C. | 标准状况下,22.4L氨水中含有NA个NH3分子 | |
| D. | 常温常压下,24g镁条投入足量稀硫酸中生成22.4L H2 |
12.近年来,“地沟油”的处理成为一个与食品安全密切相关的话题.据报道,2013年4月24日,东航首次成功进行了由地沟油生产的生物航空燃油的验证飞行.下列方法中,能区别地沟油(餐饮废弃油)与矿物油(汽油、煤油、柴油等)的方法是( )
| A. | 加入水中,浮在水面上的是地沟油 | |
| B. | 测定沸点,有固定沸点的是矿物油 | |
| C. | 点燃,能燃烧的是矿物油 | |
| D. | 加入含酚酞的氢氧化钠溶液,加热,红色变浅或消失的是地沟油 |
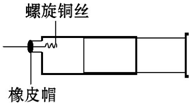 某同学采用如图装置进行实验,证明了铜与稀硝酸反应生成了NO.实验时,先向注射器内加入一定量的稀硝酸,排净注射器内的空气,迅速将带有铜丝的橡皮帽盖上,一段时间后,注射器内有无色气体产生.
某同学采用如图装置进行实验,证明了铜与稀硝酸反应生成了NO.实验时,先向注射器内加入一定量的稀硝酸,排净注射器内的空气,迅速将带有铜丝的橡皮帽盖上,一段时间后,注射器内有无色气体产生. 某学习小组为证明并观察铜与稀HNO3反应的产物是NO,设计了如图所示的
某学习小组为证明并观察铜与稀HNO3反应的产物是NO,设计了如图所示的