题目内容
14.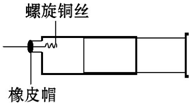 某同学采用如图装置进行实验,证明了铜与稀硝酸反应生成了NO.实验时,先向注射器内加入一定量的稀硝酸,排净注射器内的空气,迅速将带有铜丝的橡皮帽盖上,一段时间后,注射器内有无色气体产生.
某同学采用如图装置进行实验,证明了铜与稀硝酸反应生成了NO.实验时,先向注射器内加入一定量的稀硝酸,排净注射器内的空气,迅速将带有铜丝的橡皮帽盖上,一段时间后,注射器内有无色气体产生.(1)请写出铜与稀硝酸反应的化学方程式3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O.
(2)为证明无色气体是NO,取下橡皮帽,将注射器往后拉,即看到红棕色气体产生,该气体是NO2(填化学式).将此气体通入水中,发生反应的化学方程式为3NO2+H2O=2HNO3+NO.
(3)若将铜丝改为铁丝,反应后取出注射器中部分溶液,滴加KSCN溶液,若溶液变成血红色,则证明有Fe3+生成.
(4)实验结束后,为防止污染,某同学设计了最简单的方法给予解决:在注射器口塞上一团沾有NaOH(填化学式)溶液的棉花.
分析 (1)铜和稀硝酸反应生成NO气体;
(2)根据NO与氧气反应生成红棕色NO2的性质检验;NO2可与水反应生成硝酸和NO;
(3)检验三价铁用KSCN溶液,看是否变成血红色;
(4)根据氮的氧化物有毒,最终要用碱来吸收分析.
解答 解:(1)铜和稀硝酸反应生成NO气体,反应的化学方程式为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,故答案为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;
(2)NO与氧气反应生成红棕色NO2,可取下橡皮帽,无色气体变为红棕色(或注射器出口处有红棕色气体),说明无色气体为NO;NO2可与水反应生成硝酸和NO,反应的方程式为3NO2+H2O═2HNO3+NO,故答案为:NO2;3NO2+H2O=2HNO3+NO;
(3)检验三价铁用KSCN溶液,看是否变成血红色,故答案为:KSCN;血红;
(4)因为氮的氧化物有毒,所以最终要用碱来吸收,则为防止污染,某同学设计了最简单的方法给予解决:在注射器口塞上一团沾有NaOH溶液的棉花,故答案为:NaOH.
点评 本题考查无机化合物知识,侧重于硝酸、氮氧化物的性质的考查,解答该类题目,检验加强基础知识的学习,掌握物质的性质、反应现象以及有关反应方程式的书写,题目难度不大.

练习册系列答案
相关题目
4.在实验室可以用图所示的装置制取乙酸乙酯,下列说法不正确的是( )
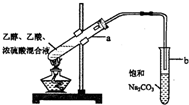

| A. | 向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加入乙酸 | |
| B. | 饱和碳酸钠溶液可以除去乙酸乙酯中混有的乙酸 | |
| C. | 向a试管中加入几块碎瓷片的作用是防止加热时液体暴沸 | |
| D. | 将制得的乙酸乙酯分离出来,应采用“分液”的实验操作 |
5.已知:①向KClO3晶体中滴加浓盐酸,产生黄绿色气体.②向NaI溶液中通入少量实验①产生的气体,溶液变黄色.③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色.下列判断正确的是( )
| A. | 实验①证明KClO3具有还原性 | |
| B. | 实验②中氧化剂与还原剂的物质的量之比为2:1 | |
| C. | 实验③说明KI被氧化 | |
| D. | 上述实验证明氧化性:ClO3->Cl2>I2 |
2.下列相关反应的离子方程式书写正确的是( )
| A. | 将钠粒投入CuSO4溶液中:2Na+Cu2+═Cu+2Na+ | |
| B. | 将NaHSO4溶液滴加到含有酚酞的Ba(OH)2溶液中,溶液由红色变成无色:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| C. | 硫化钠溶液中加入少量的氯化铁溶液:S2-+2Fe3+═2Fe2++S↓ | |
| D. | 将少量醋酸加入到NaAlO2溶液中:CH3COOH+AlO2-+H2O═CH3COO-+Al(OH)3↓ |
9.下列无色溶液中能大量共存的一组离子是( )
| A. | H+、Ba2+、ClO-、SO42- | B. | Fe3+、H+、SO42-、I- | ||
| C. | Cu2+、NO3-、HCO3-、OH- | D. | K+、Ba2+、NO3-、Cl- |
19.在密闭定容容器中,有可逆反应:nA(g)+mB(g)?pC(g)+qD(g)△H>0处于平衡状态(已知m+n>p+q),下列说法正确的是( )
①升温时C(B)/C(C)的值减小
②降温时,体系内混合气体的平均相对分子质量增大
③加入B后,A的转化率变大.
①升温时C(B)/C(C)的值减小
②降温时,体系内混合气体的平均相对分子质量增大
③加入B后,A的转化率变大.
| A. | ①②③ | B. | ②③ | C. | ①② | D. | ①③ |
6.金属铝在高温条件下与三氧化二铁发生的置换反应称为铝热反应.铝热反应可以应用在生产上,如焊接钢轨等.某教科书对“铝热反应”实验的现象有这样的描述:“反应放出大量的热,并发出耀眼的白光”,“纸漏斗的下部被烧穿,有熔融物落入沙中”.
现已知:Al、Fe的熔点、沸点数据如下:
(1)某同学猜测,铝热反应所得到的熔融物是铁铝合金.理由是:该反应放热能使铁熔化,而铝的熔点比铁低,所以铁和铝能形成合金.你认为他的解释合理(填“合理”或“不合理”).
(2)根据已有知识设计一种验证铝热反应所得到的熔融物凝固后的固体中有单质铁的最简单物理方法:用磁铁,若能吸引则可验证产物中有Fe.
(3)设计一个简单的实验方案,证明铝热反应所得到的熔融物凝固后的固体中含有单质铝.请填写下列表格:
现已知:Al、Fe的熔点、沸点数据如下:
| 物质 | Al | Fe |
| 熔点(℃) | 660 | 1535 |
| 沸点(℃) | 2467 | 2750 |
(2)根据已有知识设计一种验证铝热反应所得到的熔融物凝固后的固体中有单质铁的最简单物理方法:用磁铁,若能吸引则可验证产物中有Fe.
(3)设计一个简单的实验方案,证明铝热反应所得到的熔融物凝固后的固体中含有单质铝.请填写下列表格:
| 所用试剂 | NaOH溶液 |
| 实验操作及现象 | 取少许熔融物,滴加氢氧化钠溶液,振荡,有气泡产生,证明熔融物中有金属铝 |
| 有关反应的化学方程式 | 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ |
3.下列试剂放置在空气中不易变质的是( )
| A. | NaCl | B. | Na2O2 | C. | FeCl2 | D. | Na2SO3 |
17.分子式为C5H11Cl的同分异构体具有的种类为( )
| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |