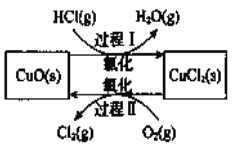
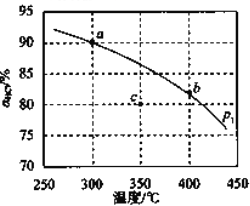
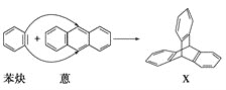
题目内容
【题目】(1)化合物BrFx与水按物质的量之比3 :5发生反应,其产物为溴酸(HBrO3)、氢氟酸、单质溴和氧气。
①BrFx中,x=__________。
②该反应的化学方程式为__________________________________________。
③此反应的氧化剂是______________,还原剂是______________。
(2)配平下列反应式,并用双线桥标出电子转移的方向和数目
____KMnO4 +____H2O2+____H2SO4 ─____K2SO4+____MnSO4+___ O2↑ + ____H2O
【答案】3 3BrF3+5H2O=HBrO3+9HF+Br2+O2↑ BrF3 BrF3、H2O 2 5 3 1 2 5 8
【解析】
(1)根据题意结合元素守恒回答第①、②问;
③根据氧化还原反应的规律解答;
(2)根据氧化还原反应的规律结合电子转移数守恒作答。
(1)将方程式配平,3BrFx+5H2O=HBrO3+3xHF+Br2+O2↑
依据H原子守恒,1+3x=10 x=3
①BrFx中,x=3。答案为:3;
②该反应的化学方程式为3BrF3+5H2O=HBrO3+9HF+Br2+O2↑。
答案为:3BrF3+5H2O=HBrO3+9HF+Br2+O2↑;
③在反应中,Br由+3价一部分转化为+5价(HBrO3),一部分转化为0价(Br2);O元素由-2价一部分转化为0价(O2),一部分没有改变。
此反应的氧化剂是BrF3,还原剂是BrF3和H2O。答案为:BrF3和H2O;
(2)KMnO4中的Mn由+7价降为+2价,H2O2中的O由-1价升为0价,按得失电子总数相等,首先配二者的化学计量数,然后依据质量守恒进行配平。
2KMnO4 +5H2O2+3H2SO4 =1K2SO4+2MnSO4+5O2↑ + 8H2O,双线桥标出电子转移的方向和数目为:
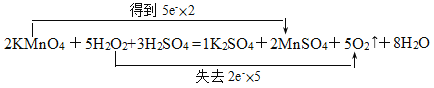
答案为:2;5 ;3 ;1;2;5;8;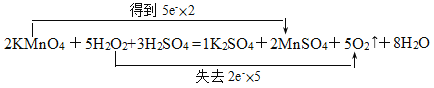

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案【题目】为探究Na2SO3溶液的性质,在白色点滴板的a、b、c、d四个凹槽中滴入Na2SO3溶液,再分别滴加下图所示的试剂。
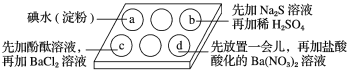
对实验现象的“解释或结论”错误的是
选项 | 实验现象 | 解释或结论 |
A | a中溶液褪色 | 还原性:SO32->I- |
B | b中加硫酸后产生淡黄色沉淀 | SO32-和S2-在酸性条件下发生反应 |
C | c中滴入酚酞溶液变红,再加BaCl2溶液后产生白色沉淀且红色褪去 | SO32-+H2O |
D | d中产生白色沉淀 | Na2SO3溶液已变质 |
A. AB. BC. CD. D