题目内容
【题目】已知A元素的一种原子没有中子;B元素的原子得1个电子后形成的离子与氩原子电子数相同;C元素的原子第三层电子数比第二层少2个;D元素的原子与A原子构成的分子A2D有10个电子。则A的元素符号为_____ ;B的离子结构示意图为_________________;C的原子结构示意图为_____________;D的元素名称为______________。
【答案】H 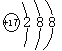
 氧
氧
【解析】
A元素的一种原子没有中子,则其为氢元素;
B元素的原子得1个电子后形成的离子与氩原子电子数相同,则其第三电子层上有7个电子,即为氯元素;
C元素的原子第三层电子数比第二层少2个,则第三层电子数为6,其为硫元素;
D元素的原子与A原子构成的分子A2D有10个电子,D的核外有8个电子,则其为氧元素,据此分析作答。
根据上述分析可知,
则A的元素符号为H。答案为H;
B的离子结构示意图为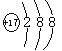 。答案为:
。答案为: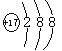 ;
;
C的原子结构示意图为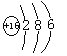 。答案为:
。答案为: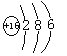 ;
;
D的元素名称为氧。答案为:氧。

练习册系列答案
相关题目