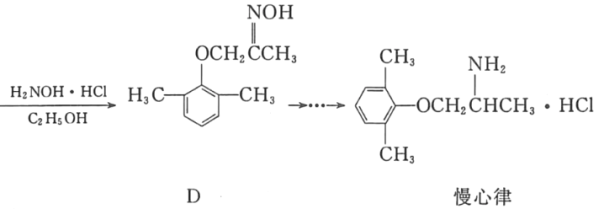
题目内容
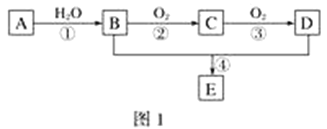
【题目】PbCrO4是一种黄色颜料,制备PbCrO4的一种实验步骤如图1:

已知:①Cr(OH)3(两性氢氧化物)呈绿色且难溶于水
②Pb(NO3)2、Pb(CH3COO)2均易溶于水,PbCrO4的Ksp为2.8×10﹣13,Pb(OH)2开始沉淀时pH为7.2,完全沉淀时pH为8.7。
③六价铬在溶液中物种分布分数与pH关系如图2所示。

④PbCrO4可由沸腾的铬酸盐溶液与铅盐溶液作用制得,含PbCrO4晶种时更易生成
(1)实验时需要配置100mL3molL﹣1CrCl3溶液,现有量筒、玻璃棒、烧杯,还需要玻璃仪器是___。
(2)“制NaCrO2(aq)”时,控制NaOH溶液加入量的操作方法是_____。
(3)“氧化”时H2O2滴加速度不宜过快,其原因是_____;“氧化”时发生反应的离子方程式为___。
(4)“煮沸”的目的是_____。
(5)请设计用“冷却液”制备PbCrO4的实验操作:_____[实验中须使用的试剂有:6molL﹣1的醋酸,0.5molL﹣1Pb(NO3)2溶液,pH 试纸]。
【答案】100 mL容量瓶和胶头滴管 不断搅拌下逐滴加入NaOH溶液,至产生的绿色沉淀恰好溶解 减小H2O2自身分解损失 2CrO2- +3H2O2 +2OH-===2CrO![]() +4H2O 除去过量的H2O2 ①在不断搅拌下,向“冷却液”中加入6 mol·L-1的醋酸至弱酸性,用pH试纸测定略小于,②先加入一滴0.5 mol·L-1 Pb(NO3)2溶液搅拌片刻产生少量沉淀,然后继续滴加至有大量沉淀,静置,③向上层清液中滴入Pb(NO3)2溶液,④若无沉淀生成,停止滴加Pb(NO3)2溶液,静置、过滤、洗涤、干燥沉淀得PbCrO4
+4H2O 除去过量的H2O2 ①在不断搅拌下,向“冷却液”中加入6 mol·L-1的醋酸至弱酸性,用pH试纸测定略小于,②先加入一滴0.5 mol·L-1 Pb(NO3)2溶液搅拌片刻产生少量沉淀,然后继续滴加至有大量沉淀,静置,③向上层清液中滴入Pb(NO3)2溶液,④若无沉淀生成,停止滴加Pb(NO3)2溶液,静置、过滤、洗涤、干燥沉淀得PbCrO4
【解析】
Cr(OH)3为两性氢氧化物,在CrCl3溶液中滴加NaOH溶液可生成NaCrO2,“制NaCrO2(aq)”时,控制NaOH溶液加入量,应再不断搅拌下逐滴加入NaOH溶液,至产生的绿色沉淀恰好溶解,再加入6%H2O2溶液,发生氧化还原反应生成Na2CrO4, “氧化”时H2O2滴加速度不宜过快,可减小H2O2自身分解损失,经煮沸可除去H2O2,冷却后与铅盐溶液作用制得PbCrO4,以此解答该题。
(1)实验时需要配置100mL3molL﹣1CrCl3溶液,现有量筒、玻璃棒、烧杯,还需要玻璃仪器是100mL容量瓶和胶头滴管,其中胶头滴管用于定容,故答案为:100mL容量瓶和胶头滴管;
(2)Cr(OH)3为两性氢氧化物,呈绿色且难溶于水,加入氢氧化钠溶液时,不断搅拌下逐滴加入NaOH溶液,至产生的绿色沉淀恰好溶解,可防止NaOH溶液过量,故答案为:不断搅拌下逐滴加入NaOH溶液,至产生的绿色沉淀恰好溶解;
(3)“氧化”时H2O2滴加速度不宜过快,可防止反应放出热量,温度过高而导致过氧化氢分解而损失,反应的离子方程式为2CrO2﹣+3H2O2+2OH﹣=2CrO42﹣+4H2O,故答案为:减小H2O2自身分解损失;2CrO2﹣+3H2O2+2OH﹣=2CrO42﹣+4H2O;
(4)煮沸可促使过氧化氢分解,以达到除去过氧化氢的目的,故答案为:除去过量的H2O2;
(5)“冷却液”的主要成分为Na2CrO4,要想制备PbCrO4,根据已知信息②由Pb(NO3)2提供Pb2+,但要控制溶液的pH不大于7.2,以防止生成Pb(OH)2沉淀,由信息③的图象可知,溶液的pH又不能小于6.5,因为pH小于6.5时CrO42﹣的含量少,HCrO4﹣的含量大,所以控制溶液的pH略小于7即可,结合信息④,需要先生成少许的PbCrO4沉淀,再大量生成。所以实验操作为在不断搅拌下,向“冷却液”中加入6molL﹣1的醋酸至弱酸性(pH略小于7),将溶液加热至沸腾,先加入一滴0.5 molL﹣1Pb(NO3)2溶液搅拌片刻产生少量沉淀,然后继续滴加至有大量沉淀,静置,向上层清液中滴入Pb(NO3)2溶液,若无沉淀生成,停止滴加,静置、过滤、洗涤、干燥;
故答案为:①在不断搅拌下,向“冷却液”中加入6 mol·L-1的醋酸至弱酸性,用pH试纸测定略小于,②先加入一滴0.5 mol·L-1 Pb(NO3)2溶液搅拌片刻产生少量沉淀,然后继续滴加至有大量沉淀,静置,③向上层清液中滴入Pb(NO3)2溶液,④若无沉淀生成,停止滴加Pb(NO3)2溶液,静置、过滤、洗涤、干燥沉淀得PbCrO4。

 出彩同步大试卷系列答案
出彩同步大试卷系列答案【题目】X、Y、Z、W是元素周期表中的短周期元素,它们的相对位置如下表所示,其中X、Y 元素均能形成10电子的氢化物,Z的原子序数是Y的2倍。请回答下列问题:
X | Y | |
Z | W |
(1)W的简单离子的结构示意图为______,Y元素在周期表中的位置是____。
(2)写出实验室制W元素单质的离子方程式:___________
(3)关于W同主族元素,下列说法正确的是:__________
A.从上到下密度逐渐增大
B.从上到下熔点和沸点都逐渐升高
C.从上到下元素的非金属性越来越强
D.同主族元素对应的单质中,只有W元素对应的单质在常态下为气态
(4)W与Z形成的液体化合物Z2W2,该物质可与水反应生成ZO2气体,1 mol Z2W2参加反应时转移1.5 mol电子,其中只有一种元素化合价发生改变,Z2W2与水反应的化学方程式为_____。