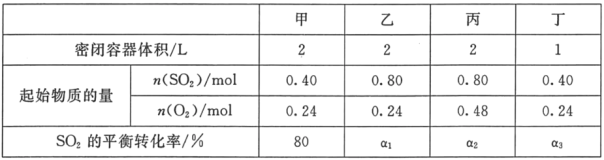
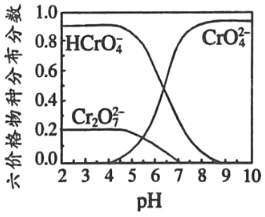
题目内容
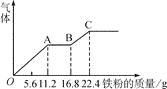
【题目】已知A为常见的金属单质,根据下图所示的关系:
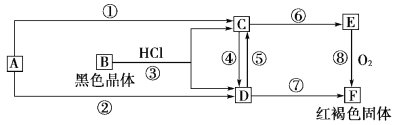
(1)确定A、B、C、D、E、F的化学式,A为________,B为________,C为________,D为________,E为________,F为________。
(2)写出⑧的化学方程式,④、⑤的离子方程式。
⑧_________________________________________________,
④________________________________________________,
⑤___________________________________________________。
【答案】Fe Fe3O4 FeCl2 FeCl3 Fe(OH)2 Fe(OH)3 4Fe(OH)2+O2+2H2O===4Fe(OH)3 2Fe2++Cl2===2Cl-+2Fe3+ Fe+2Fe3+===3Fe2+
【解析】
由转化关系图可知,红褐色固体F为Fe(OH)3,则E为Fe(OH)2,C为FeCl2,D为FeCl3,A为Fe,B为Fe3O4,然后结合物质的性质及化学用语来解答。
:由转化关系图可知,红褐色固体F为Fe(OH)3,则E为Fe(OH)2,C为FeCl2,D为FeCl3,A为Fe,B为Fe3O4,
(1)由上分析知A为Fe,B为Fe3O4,C为FeCl2,D为FeCl3,E为Fe(OH)2,F为Fe(OH)3,故答案为:Fe;Fe3O4;FeCl2;FeCl3;Fe(OH)2;Fe(OH)3;
(2)反应⑧为4Fe(OH)2的氧化,方程式为4Fe(OH)2+O2+2H2O═4Fe(OH)3,④的离子方程式为2Fe2++Cl2═2Fe3++2Cl-,⑤的离子方程式为2Fe3++Fe=3Fe2+,故答案为:4Fe(OH)2+O2+2H2O═4Fe(OH)3、2Fe2++Cl2═2Fe3++2Cl-、2Fe3++Fe=3Fe2+。

 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案