题目内容
10.二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放.(1)有一种用CO2生产甲醇燃料的方法:
已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-a kJ•mol-1;
CH3OH(g)═CH3OH(l)△H=-b kJ•mol-1;
2H2(g)+O2(g)═2H2O(g)△H=-c kJ•mol-1;
H2O(g)═H2O(l)△H=-d kJ•mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l)△H=-($\frac{3c}{2}$+2d-a-b)kJ•mol-1.
(2)在一定温度下的2L固定容积的密闭容器中,通入2molCO2和3mol H2,发生的反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),△H=-a kJ•mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图1所示.
①能说明该反应已达平衡状态的是AB.(选填编号)
A.CO2的体积分数在混合气体中保持不变
B.混合气体的平均相对分子质量不随时间的变化而变化
C.单位时间内每消耗1.2mol H2,同时生成0.4molH2O
D.该体系中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变
②计算该温度下此反应的平衡常数K=0.20.(保留两位有效数字).若改变条件C(填选项),可使K=1.
A.增大压强 B.增大反应物浓度 C.降低温度 D.升高温度 E.加入催化剂
(3)某甲醇燃料电池原理如图2所示.
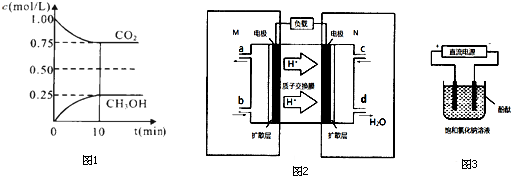
①M区发生反应的电极反应式为CH3OH-6e-+H2O=CO2+6H+.
②用上述电池做电源,用图3装置电解饱和食盐水(电极均为惰性电极),则该电解的总反应离子方程式为:2Cl-+2H2O=H2↑+Cl2↑+2OH-.假设溶液体积为300mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为0.16g(忽略溶液体积变化).
分析 (1)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(2)①化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断;
②根据图象数据结合平衡常数K的计算公式进行计算,根据K仅与温度有关及反应为放热来判断改变条件;
(3)①首先根据氢离子的移动方向来确定正负极,然后根据原电池原理书写电极反应式;
②整个电路中转移电子的数目相等,可以根据电子转移的数目相同来列出已知物质和未知物质之间关系式,然后通过关系来求解.
解答 解:(1)①CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-a kJ•mol-1;
②CH3OH(g)═CH3OH(l)△H=-b kJ•mol-1;
③2H2(g)+O2(g)═2H2O(g)△H=-c kJ•mol-1;
④H2O(g)═H2O(l)△H=-d kJ•mol-1,
依据盖斯定律③×$\frac{3}{2}$+④×2-①-②,得到CH3OH(l)燃烧热的热化学方程式为:CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l)△H=-($\frac{3c}{2}$+2d-a-b)kJ•mol-1,
故答案为:CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l)△H=-($\frac{3c}{2}$+2d-a-b)kJ•mol-1;
(2)①A.CO2的体积分数在混合气体中保持不变,则能说明达到平衡状态,故A正确;
B.总质量一定,反应前后气体物质的量发生变化,混合气体的平均相对分子质量不随时间的变化而变化能说明达到平衡状态,故B正确;
C.单位时间内每消耗1.2mol H2,同时生成0.4molH2O,不能体现正逆反应,故不能说明达到平衡状态,故C错误;
D.H2O与CH3OH都是产物,并且按照1:1的比例生成,所以H2O与CH3OH的物质的量浓度之比一直为1:1,不能说明达到平衡状态,故D错误;
故答案为:AB;
②由图象数据 CO2(g)+3H2(g)?CH3OH(g)+H2O(g)得
开始浓度:1 1.5 0 0
转化浓度:0.25 0.75 0.25 0.25
平衡浓度:0.75 0.75 0.25 0.25
所以K=$\frac{0.25×0.25}{0.75×0.7{5}^{3}}$=0.20,则要使K=1,又反应放热所以降低温度使平衡向正反应方向移动,
故答案为:0.20;C;
(3)①M区是质子流出的一极,应是原电池的负极,发生氧化反应,电极反应式为:CH3OH-6e-+H2O=CO2+6H+,
故答案为:CH3OH-6e-+H2O=CO2+6H+;
②用惰性电极,电解饱和食盐水总的电极反应式为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-,
pH值变为13时,pOH=1,c(OH-)=0.1mol/L,n(OH-)=0.1mol/L×0.3L=0.03mol,由方程式CH3OH-6e-+H2O=CO2+6H+,2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-可知
CH3OH~6e-~6OH-
32g 6mol
m(CH3OH) 0.03mol
则m(CH3OH)=32g×0.03mol÷6mol=0.16g,
故答案为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-;0.16g.
点评 本题考查了化学平衡的有关知识,电极反应式的书写等,综合性强,但难度不大.

| A. | 若不改变其它条件而换用一种更高效的催化剂,则反应达限度的时间会增长 | |
| B. | 达平衡后向容器中只充入O2不能提高反应速率 | |
| C. | 达到平衡时,SO2的转化率是80% | |
| D. | 将平衡混合气体通入过量BaCl2溶液中,得到沉淀的质量为114.90g |
| A. | 大理石溶于醋酸溶液:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 向FeBr2溶液中通入足量氯气:2Fe2++4Br++3Cl2═2Fe3++2Br2+6Cl- | |
| C. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O | |
| D. | 向明矾(KAl(SO4)2•12H2O溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |
| A. | 都是2mol/L | B. | 都是3mol/L | ||
| C. | 1.5mol/L和3mol/L | D. | 分别是1mol/L和4mol/L |
| A. | 3:4 | B. | 1:2 | C. | 2:3 | D. | 3:2 |

 .分子式为C5H12烃的一氯代物只有一种的结构简式是C (CH3)4.
.分子式为C5H12烃的一氯代物只有一种的结构简式是C (CH3)4.