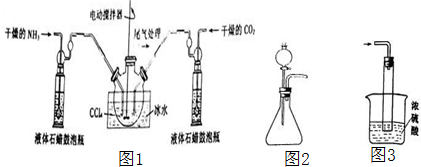
题目内容
19.已知反应:①2C(s)+O2(g)═2CO(g)△H=-221kJ/mol
②稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol
下列结论正确的是( )
| A. | 碳的燃烧热110.5 kJ/mol | |
| B. | ①的反应热为221 kJ/mol | |
| C. | 稀醋酸与稀NaOH溶液反应的中和热为57.3kJ/mol | |
| D. | 稀盐酸与稀NaOH溶液反应的中和热为57.3kJ/mol |
分析 A、依据燃烧热是1mol可燃物完全燃烧生成稳定氧化物反应放出的热量分析判断;
B、反应热包含符号,①的反应热为-221 kJ•mol-1;
C、醋酸是弱酸存在电离平衡,电离过程是吸热过程分析;
D、依据中和热是强酸和强碱稀溶液反应生成1mol水放出的热量分析判断.
解答 解:A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物反应放出的热量,反应①生成的氧化物是一氧化碳不是稳定氧化物,故热量不能计算燃烧热,故A错误;
B、2C(s)+O2(g)=2CO(g)△H=-221kJ/mol,反应热包含符号,反应的反应热为-221KJ/mol,故B错误;
C、醋酸是弱电解质,电离需吸收热量,稀醋酸与稀NaOH溶液反应生成1mol水,放出的热量小于57.3 kJ,故C错误;
D、稀的强酸、强碱的中和热为△H=-57.3kJ/mol,稀盐酸与稀NaOH溶液反应的中和热为57.3 kJ/mol,故D正确;
故选D.
点评 本题考查学生对于反应热、中和热的理解及有关计算等,难度不大,注意稀的强酸、强碱的中和热为△H=-57.3kJ/mol.

练习册系列答案
相关题目
14.在三个密闭容器中分别充入A、B、C三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)从大到小的顺序为p(B)>p(A)>p(C),则A、B、C分别是( )
| A. | Ne、H2、O2 | B. | O2、N2、H2 | C. | NO、CO2、H2 | D. | NH3、O2、NO2 |
4.下列叙述正确的是(NA为阿伏加德罗常数的数值)( )
| A. | 22.4LCO2含有NA个CO2分子 | B. | 0.1NA个H2SO4分子的质量为9.8克 | ||
| C. | 10gCaCO3含有NA个C原子 | D. | 2molCl2含有2NA个Cl原子 |
11.下列试剂可贮存在磨口试剂瓶的是( )
| A. | NaCl溶液 | B. | Na2SiO3溶液 | C. | 氢氟酸 | D. | NaOH溶液 |
8.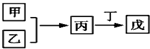 甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法不正确的是( )
甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法不正确的是( )
 甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法不正确的是( )
甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法不正确的是( )| A. | 若甲既能与盐酸反应又能与NaOH溶液反应,则丙可能属于两性氧化物 | |
| B. | 若丙、丁混合产生白烟,且丙为18电子分子,则乙的水溶液可能具有漂白作用 | |
| C. | 若甲、丙、戊含有同一种元素,该元素的化合价由低到高的顺序可能为甲<丙<戊 | |
| D. | 若甲为短周期中原子半径最大的主族元素的单质,且戊为碱,则丙只能为Na2O2 |
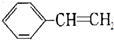 制取 聚苯乙烯
制取 聚苯乙烯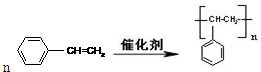 .
.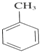 +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$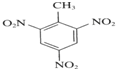 +3H2O.
+3H2O.