题目内容
9.(1)室温下pH=9的NaOH溶液中,由水电离产生的c(OH-)为10-9mol•L-1;把0.1mol•L-1的HCl与0.3mol•L-1的NaOH溶液等体积混合,所得溶液的pH=13.(2)100mL3mol•L-1H2SO4溶液与足量的Zn反应,为使产生的H2速率减慢,但不影响H2的总量,可采取的措施是AC(填字母).
A.加CH3COOK固体 B.加NH4Cl固体 C.加Ba(NO3)2溶液 D.加氨水
(3)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈碱性(填“酸性”“中性”或“碱性”),原因是:CH3COO-+H2O?CH3COOH+OH-(用相关化学用语表示)
(4)有NH4Cl和NH3•H2O组成的混合液,若其pH=7,则该溶液中c(NH4+)=c(Cl-);若pH>7,则该溶液中c(NH4+)>c(Cl-).(填“>”“<”或“=”)
(5)0.1mol•L-1的NaHSO3溶液中,c(Na+)+c(H+)=c(OH-)+c(HSO3-)+2c(SO32-).(表达式)
分析 (1)NaOH抑制水的电离,根据Kw=c(OH-)×c(H+)以及pH=-lg(c(H+))计算;
(2)减慢反应速率,可降低温度或浓度,产生的H2的总量不变,则氢离子的总物质的量不变,以此解答;
(3)醋酸为弱酸,将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,恰好生成醋酸钠,为强碱弱酸盐,溶液呈碱性;
(4)常温下,混合溶液中pH=7说明溶液呈中性,C(H+)=C(OH-),根据电荷守恒判断铵根离子浓度和氯离子浓度的关系;若pH>7,说明溶液呈碱性,溶液中氢离子浓度小于氢氧根离子浓度,根据电荷守恒判断铵根离子浓度和氯离子浓度的关系;
(5)根据混合液中的电荷守恒分析.
解答 解:(1)室温下pH=9的NaOH溶液中,c(OH-)=10-5mol/L,c(H+)=10-9mol/L,则由水电离产生的c(OH-)为10-9mol/L,
把0.1mol/LHCl与0.3mol/L的NaOH溶液等体积混合,NaOH过量,c(OH-)=$\frac{0.3mol/L×V-0.1mol/L×V}{2V}$=0.1mol/L,c(H+)=10-13mol/L,所得溶液的pH=13,
故答案为:10-9;13;
(2)A.加醋酸钾固体,生成醋酸为弱电解质,溶液氢离子浓度降低,反应速率减小,但生成氢气的总量不变,故A正确;
B.加NH4Cl溶液,氯化铵水解呈酸性,生成氢气的总量增大,故B错误;
C.加Ba(NO3)2溶液,氢离子总量不变,应溶液总体积增大,氢离子浓度降低,反应速率减小,故C正确;
D.加氨水,消耗酸,生成氢气总量减小,故D错误;
故答案为:AC;
(3)醋酸为弱电解质,将等体积、等物质的量浓度的醋酸和氢氧化钠溶液混合后,恰好生成CH3COONa,为强碱弱酸盐,醋酸根离子发生水解:CH3COO-+H2O?CH3COOH+OH-,溶液呈碱性,
故答案为:碱性;CH3COO-+H2O?CH3COOH+OH-;
(4)常温下,混合溶液中pH=7说明溶液呈中性,则溶液中c(H+)=c(OH-),根据电荷守恒得c(H+)+c(NH4+)=c(OH-)+c(Cl-),则c(NH4+)=c(Cl-);
若pH>7,说明溶液呈碱性,则c(H+)<c(OH-),根据电荷守恒得c(H+)+c(NH4+)=c(OH-)+c(Cl-),则c(NH4+)>c(Cl-),
故答案为:=;>;
(5)0.1mol•L-1的NaHSO3溶液中,根据电荷守恒可得:c(Na+)+c(H+)=c(OH-)+c(HSO3-)+2c(SO32-),故答案为:c(OH-)+c(HSO3-)+2c(SO32-).
点评 本题考查了离子浓度大小比较、盐的水解原理及其影响、溶液pH的计算等知识,题目难度中等,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及灵活应用能力,注意明确溶液酸碱性与溶液pH的关系及计算方法.

 阅读快车系列答案
阅读快车系列答案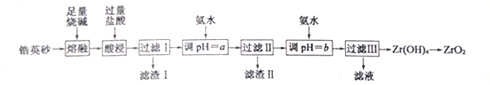
已知:①ZrO2能与烧碱反应生成可溶于水的Na2ZrO3,Na2ZrO3与酸反应生成ZrO2+.
②部分离子在实验条件下开始沉淀和完全沉淀时的pH如下表:
| 离子 | Fe3+ | Al3+ | ZrO2+ |
| 开始沉淀时pH | 1.9 | 3.3 | 6.2 |
| 完全沉淀时pH | 3.2 | 5.2 | 8.0 |
(2)写出酸浸时生成Al3+、Fe3+的离子方程式Fe2O3+6H+=Fe3++3H2O,AlO2-+4H+=Al3++2H2O.
(3)滤渣Ⅰ的主要成分的名称为硅酸.
(4)向过滤Ⅱ所得滤液中加氨水调pH=b,则b的范围是5.2~6.2.
(5)向过滤Ⅲ所得的滤液中加入CaCO3粉末并加热,可得到CO2和另一种气体.该反应的离子方程式为2NH4++CaCO3=Ca2++2NH3↑+CO2↑+H2O.
(6)一种新型燃料电池,一极通入空气,另一极通入丁烷;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-.在熔融电解质中,O2-向负(填“正”或“负”)极移动.负极电极反应为:C4H10-26e-+13O2-=4CO2+5H2O.
| A. | H2S+H2SO4(浓) | B. | Cu+H2SO4(浓) | C. | C+H2SO4 (浓) | D. | CuO+H2SO4 (浓) |
| A. | 地沟油不能食用,但可以在循环经济中发挥作用 | |
| B. | 多用电子邮件、QQ、飞信等即时通讯工具,少用传真打印机,属于“低碳生活”方式 | |
| C. | 实施绿化工程,可以有效地防治PM2.5污染 | |
| D. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱也不会“断路” |
| 选项 | 操作及现象 | 溶液 |
| A | 通入SO2,溶液不变浑浊,再通CO2,溶液仍不变浑浊 | BaCl2溶液 |
| B | 通入足量CO2,溶液变浑浊,再加入品红溶液,红色褪去 | Ca(ClO)2溶液 |
| C | 通入SO2,溶液变浑浊,继续通SO2至过量,浑浊消失,再加入足量NaOH溶液,又变浑浊 | Ca(OH)2溶液 |
| D | 通入等物质的量的SO2和Cl2混合气体,溶液无变化,再通SO2,溶液褪色 | 品红溶液 |
| A. | A | B. | B | C. | C | D. | D |
 某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2ΝΗ3(g)+CO2(g)
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2ΝΗ3(g)+CO2(g)实验测得不同温度下的平衡数据列于下表:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总 浓度/mol•L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
A.v正(NH3)=2v逆(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时的分解平衡常数:K=1.6×10-8(mol•L-1)3.
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量将增加(填“增加”、“减少”或“不变”).
④氨基甲酸铵分解反应的焓变△H>0(填“>”、“=”或“<”),熵变△S>0(填“>”、“=”或“<”).
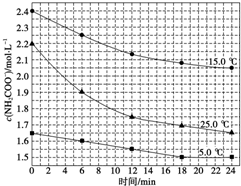
(2)已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O,该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间的变化趋势如图所示.
⑤计算25.0℃时,0~6min氨基甲酸铵水解反应的平均速率:0.05mol/(L•min).
①2C(s)+O2(g)═2CO(g)△H=-221kJ/mol
②稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol
下列结论正确的是( )
| A. | 碳的燃烧热110.5 kJ/mol | |
| B. | ①的反应热为221 kJ/mol | |
| C. | 稀醋酸与稀NaOH溶液反应的中和热为57.3kJ/mol | |
| D. | 稀盐酸与稀NaOH溶液反应的中和热为57.3kJ/mol |
 烯烃A在一定条件下可以按如图的框图进行反应.
烯烃A在一定条件下可以按如图的框图进行反应.