题目内容
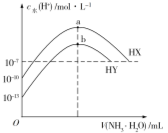
【题目】已知在稀溶液中,酸跟碱发生中和反应生成1 mol水时的反应热叫做中和热。现利用如图装置进行中和热的测定,请回答下列问题:
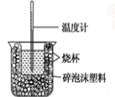
(1)图示装置有两处重要组成部分未画出,它们是 、 。
(2)烧杯间填满碎泡沫塑料的作用是 。
(3)若操作时分几次注入反应液,求得的反应热数值 (填“偏大”“偏小”或“无影响”)。
(4)做一次完整的中和热测定实验,温度计需使用 次。
(5)量取0.5 mol/L的盐酸和0.55 mol/L的NaOH溶液各50 mL进行实验,测得盐酸和NaOH溶液起始平均温度为t1℃,混合反应后最高温度为t2℃,设溶液密度均为1 g/mL,生成溶液的比热容c= 4.18 J/g℃。请列式计算中和热:△H= kJ/mol(不用化简)。
【答案】(1)硬纸板(1分) 环形玻璃搅拌棒(1分) (2)减少实验过程中的热量损失(1分)
(3)偏小(1分) (4)3(2分) (5)(0.418(t2t1)/0.025)(3分)
【解析】(1)在中和热的测定实验中,保温,减少热量损失是实验的关键步骤,所以图示装置有两处重要组成部分未画出,它们是硬纸板和环形玻璃搅拌棒。(2)为了减少实验过程中的热量损失,烧杯间填满碎泡沫塑料。(3)若操作时分几次注入反应液,会导致热量散失较多,求得的反应热数值偏小。(4)盐酸和氢氧化钠溶液的温度都需要测量,反应后还需要测量混合液的温度,所以至少使用3次。(5)50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液的质量之和是100 g,所以反应过程中放出的热量是100 g×4.18 J/(g℃)×Δt ℃=0.418(t2-t1)kJ。因为50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/LNaOH溶液反应生成水是0.025 mol,所以ΔH=(0.418(t2t1)/0.025)kJ/mol。