题目内容
15.一般情况下,前者无法决定后者的是( )| A. | 原子核外电子排布--元素在周期表中的位置 | |
| B. | 弱电解质的相对强弱--电离常数的大小 | |
| C. | 分子间作用力的大小--分子稳定性的高低 | |
| D. | 物质内部储存的能量--化学反应的热效应 |
分析 A、元素在周期表中呈现规律性的变化与其核外电子排布有关;
B、电离常数越大说明该弱电解质越易电离;
C、稳定性与化学键有关,分子间作用力决定物质的物理性质;
D、物质内部储存的能量即键能,断开化学键与形成化学键决定化学反应的热效应.
解答 解:A、因为原子核外电子排布呈现规律性的变化,故元素在周期表中的位置也呈现规律性的变化,即原子核外电子排布决定了元素在周期表中的位置,故A正确;
B、相同类型的弱电解质,其电离常数越大说明该弱电解质越易电离,故B正确;
C、稳定性与化学键有关,分子间作用力决定物质的物理性质,则分子晶体的稳定性决定于其中的化学键,故C错误;
D、反应物的总能量大于生成物的总能量,则反应放热,否则吸热,即物质内部储存的能量决定了化学反应的热效应,故D正确,
故选C.
点评 本题主要考查的是元素周期表的形成、弱电解质的电离与电离常数、反应热效应等,综合性较强,有一定难度.

练习册系列答案
相关题目
5. 对碳硫及其化合物的研究有重要的意义.
对碳硫及其化合物的研究有重要的意义.
I.利用水煤气合成二甲醚(CH3OCH3)的三步反应如下:
①2H2(g)+CO(g)═CH3OH(g)△H=-90.8kJ.mol-1
②2CH3OH(g)═CH3OCH3(g)+H2O(g)△H=-23.5kJ.mol-1
③CO(g)+H2O(g)═CO2+H2(g)△H=-41.3kJ.mol-1
写出利用水煤气合成二甲醚(CH3OCH3) 的热化学方程式:3CO(g)+3H2(g)═CH3OCH3(g)+CO2(g)△H=-246.4kJ•mol-1.
Ⅱ.工业制硫酸的过程中利用反应2SO2(g)+O2(g)$?_{加热}^{催化剂}$SO3(g)△H=-196.6kJ•mol-1,将SO2转化为SO3,尾气SO3可用NaOH溶液进行吸收.请回答下列问题:
(1)写出该反应的化学平衡常数表达式:K=$\frac{c{\;}^{2}(SO{\;}_{3})}{c{\;}^{2}(SO{\;}_{2})•c(O{\;}_{2})}$.
(2)一定条件下,向一带活塞的密闭容器中充入2mol SO2和1mol O2发生反应,下列说法中正确的是BC(填字母).
A.若反应速率v正(O2)=2v逆(SO3),则可以说明该可逆反应已达到平衡状态
B.保持温度和容器体积不变,再充入2mol SO2和1mol O2,n(SO3)/n(SO2)增大
C.平衡后移动活塞压缩气体,达到平衡时SO2、O2的百分含量减小,SO3的百分含量增大
D.平衡后升高温度,平衡常数K增大
(3)将一定量的SO2(g)和O2(g)分别通入到容积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据:
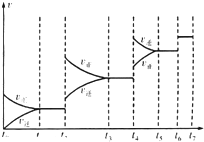
实验1从开始到反应达到化学平衡时,v(SO2)表示的反应速率为0.2mol/L•min;T1>T2(选填“>”“<”或“=”),理由是反应放热,温度升高平衡向左移动,反应物转化率低
(4)某SO2(g)和O2(g)反应体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图所示.若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是升高温度;图中表示平衡混合物中SO2的转化率最高的一段时间是t3~t4.
 对碳硫及其化合物的研究有重要的意义.
对碳硫及其化合物的研究有重要的意义.I.利用水煤气合成二甲醚(CH3OCH3)的三步反应如下:
①2H2(g)+CO(g)═CH3OH(g)△H=-90.8kJ.mol-1
②2CH3OH(g)═CH3OCH3(g)+H2O(g)△H=-23.5kJ.mol-1
③CO(g)+H2O(g)═CO2+H2(g)△H=-41.3kJ.mol-1
写出利用水煤气合成二甲醚(CH3OCH3) 的热化学方程式:3CO(g)+3H2(g)═CH3OCH3(g)+CO2(g)△H=-246.4kJ•mol-1.
Ⅱ.工业制硫酸的过程中利用反应2SO2(g)+O2(g)$?_{加热}^{催化剂}$SO3(g)△H=-196.6kJ•mol-1,将SO2转化为SO3,尾气SO3可用NaOH溶液进行吸收.请回答下列问题:
(1)写出该反应的化学平衡常数表达式:K=$\frac{c{\;}^{2}(SO{\;}_{3})}{c{\;}^{2}(SO{\;}_{2})•c(O{\;}_{2})}$.
(2)一定条件下,向一带活塞的密闭容器中充入2mol SO2和1mol O2发生反应,下列说法中正确的是BC(填字母).
A.若反应速率v正(O2)=2v逆(SO3),则可以说明该可逆反应已达到平衡状态
B.保持温度和容器体积不变,再充入2mol SO2和1mol O2,n(SO3)/n(SO2)增大
C.平衡后移动活塞压缩气体,达到平衡时SO2、O2的百分含量减小,SO3的百分含量增大
D.平衡后升高温度,平衡常数K增大
(3)将一定量的SO2(g)和O2(g)分别通入到容积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据:
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| SO2 | O2 | SO2 | O2 | |||
| 1 | T1 | 4 | 2 | X | 0.8 | 6 |
| 2 | T2 | 4 | 2 | 0.4 | Y | t |
(4)某SO2(g)和O2(g)反应体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图所示.若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是升高温度;图中表示平衡混合物中SO2的转化率最高的一段时间是t3~t4.
6.硫铁矿是工业制硫酸的主要原料,某硫铁矿中含FeS2,假设杂质不参与反应,用酸性高锰酸钾溶液滴定法测定硫铁矿的纯度,其反应原理:FeS2+3MnO4-+8H+═3Mn2++Fe3++2SO42-+4H2O.取x g该样品磨成粉末滴加c mol•L-1酸性高锰酸钾溶液至恰好完全反应,消耗酸性高锰酸钾溶液V mL.则该样品的纯度为( )
| A. | $\frac{cV}{x}$×100% | B. | $\frac{cV}{25x}$×100% | C. | $\frac{40cV}{x}$×100% | D. | $\frac{cV}{4x}$×100% |
3.中国科学技术名词审定委员会已确定第116号元素Lv的名称为鉝.关于${\;}_{116}^{293}$Lv的叙述错误的是( )
| A. | 原子序数116 | B. | 中子数177 | C. | 核外电子数116 | D. | 相对原子质量293 |
10.已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如图所示.下列说法正确的是( )
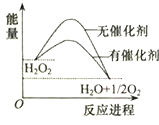

| A. | 加入催化剂,减小了反应的热效应 | |
| B. | 加入催化剂,可提高H2O2的平衡转化率 | |
| C. | H2O2分解的热化学方程式:H2O2→H2O+$\frac{1}{2}$O2+Q | |
| D. | 反应物的总能量高于生成物的总能量 |
20.将O2和NH3的混合气体448mL通过加热的三氧化二铬,充分反应后,再通过足量的水,最终收集到44.8mL气体.原混合气体中O2的体积可能是(假设氨全部被氧化;气体体积均已换算成标准状况)( )
| A. | 231.5mL | B. | 268.8mL | C. | 287.5mL | D. | 313.6mL |
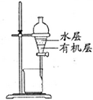
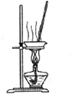
3.下列有关实验装置进行的相应实验,能达到实验目的是( )
| A | B | C | D |
| 除去Cl2中的HCl | 制取少量纯净的CO2气体 | 分离CCl4萃取碘水后已分层的有机层和水层 | 蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
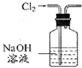 | 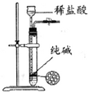 |  |  |
| A. | A | B. | B | C. | C | D. | D |
2.下列推断正确的是( )
| A. | 硅是地壳中含量位居第二的元素,玛瑙、光导纤维的主要成分为SiO2 | |
| B. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| C. | 加碘食盐中加入的是碘单质,可防止甲状腺肿大疾病 | |
| D. | 要除去衣服上的顽固污渍,均可将衣服泡在漂白液中 |