题目内容
5. 对碳硫及其化合物的研究有重要的意义.
对碳硫及其化合物的研究有重要的意义.I.利用水煤气合成二甲醚(CH3OCH3)的三步反应如下:
①2H2(g)+CO(g)═CH3OH(g)△H=-90.8kJ.mol-1
②2CH3OH(g)═CH3OCH3(g)+H2O(g)△H=-23.5kJ.mol-1
③CO(g)+H2O(g)═CO2+H2(g)△H=-41.3kJ.mol-1
写出利用水煤气合成二甲醚(CH3OCH3) 的热化学方程式:3CO(g)+3H2(g)═CH3OCH3(g)+CO2(g)△H=-246.4kJ•mol-1.
Ⅱ.工业制硫酸的过程中利用反应2SO2(g)+O2(g)$?_{加热}^{催化剂}$SO3(g)△H=-196.6kJ•mol-1,将SO2转化为SO3,尾气SO3可用NaOH溶液进行吸收.请回答下列问题:
(1)写出该反应的化学平衡常数表达式:K=$\frac{c{\;}^{2}(SO{\;}_{3})}{c{\;}^{2}(SO{\;}_{2})•c(O{\;}_{2})}$.
(2)一定条件下,向一带活塞的密闭容器中充入2mol SO2和1mol O2发生反应,下列说法中正确的是BC(填字母).
A.若反应速率v正(O2)=2v逆(SO3),则可以说明该可逆反应已达到平衡状态
B.保持温度和容器体积不变,再充入2mol SO2和1mol O2,n(SO3)/n(SO2)增大
C.平衡后移动活塞压缩气体,达到平衡时SO2、O2的百分含量减小,SO3的百分含量增大
D.平衡后升高温度,平衡常数K增大
(3)将一定量的SO2(g)和O2(g)分别通入到容积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据:
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| SO2 | O2 | SO2 | O2 | |||
| 1 | T1 | 4 | 2 | X | 0.8 | 6 |
| 2 | T2 | 4 | 2 | 0.4 | Y | t |
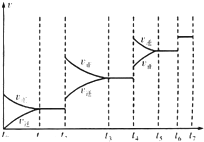
(4)某SO2(g)和O2(g)反应体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图所示.若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是升高温度;图中表示平衡混合物中SO2的转化率最高的一段时间是t3~t4.
分析 Ⅰ、①2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.3kJ•mol-1
由盖斯定律可知,通过①×2+②+③可得水煤气合成二甲醚(CH3OCH3) 的热化学方程式;
Ⅱ、(1)依据化学方程式和平衡常数概念书写表达式;
(2)恒温恒压容器达到平衡,反应是气体体积减小的放热反应,依据平衡移动原理分析选项,平衡标志是正逆反应速率相同,各组分含量保持不变;
(3)分析图表数据,依据化学平衡三段式列式,结合反应速率概念计算;依据图表数据列式计算分析,反应是放热反应,化学平衡随温度升高,平衡逆向进行分析两次实验的温度;
(4)t4时正逆反应速率都较原平衡时的速率大,可升高温度或增大压强;t6时正逆反应速率都较原平衡时的速率大,但平衡不移动,前后气体系数之和不等,只能是使用催化剂;在反应向逆反应之前衡混合物中CO的含量最高;
解答 解:Ⅰ、①2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.3kJ•mol-1
由盖斯定律可知,通过①×2+②+③可得所求反应方程式,则3CO(g)+3H2(g)═CH3OCH3(g)+CO2(g)△H=-90.8kJ•mol-1×2-23.5kJ•mol-1-41.3kJ•mol-1=-246.4kJ•mol-1;
故答案为:3CO(g)+3H2(g)═CH3OCH3(g)+CO2(g)△H=-246.4kJ•mol-1;
Ⅱ、(1)2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g),依据平衡常数概念写出表达式,K=$\frac{c{\;}^{2}(SO{\;}_{3})}{c{\;}^{2}(SO{\;}_{2})•c(O{\;}_{2})}$;
故答案为:K=$\frac{c{\;}^{2}(SO{\;}_{3})}{c{\;}^{2}(SO{\;}_{2})•c(O{\;}_{2})}$;
(2)恒温恒压容器达到平衡,反应是气体体积减小的放热反应,依据平衡移动原理分析选项;
A.反应速率之比等于化学方程式系数之比,是正反应速率之比,若反应速率2υ正(O2)=υ逆(SO3),才可以说明该可逆反应已达到平衡状态,故A错误;
B.保持温度和容器体积不变,再充入2mol SO2和1mol O2,等效于将体积扩大2倍,平衡状态一样,再压缩到原来的体积,平衡向正反应方向移动,所以n(SO3)/n(SO2)增大,故B正确;
C.平衡后移动活塞压缩气体,压强增大,平衡正向进行,平衡时SO2、O2的百分含量减小,SO3的百分含量增大,故C正确;
D.反应是放热反应,平衡后升高温度,平衡逆向进行,平衡常数K减小,故D错误.
故答案为:BC;
(3)实验1从开始到反应达到化学平衡时,
2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g);
起始量(mol) 4 2 0
变化量(mol) 2.4 1.2 2.4
平衡量(mol) x 0.8 2.4
v(SO2)表示的反应速率=$\frac{\frac{2.4mol}{2L}}{6min}$=0.2mol/L•min;
反应起始量相同,达到平衡时氧气物质的量可知,实验2反应进行的程度大,反应是放热反应,温度越高,平衡向吸热反应方向进行,逆向进行,所以温度T1>T2,
故答案为:0.2mol/L•min;>; 反应放热,温度升高平衡向左移动,反应物转化率低;
(4)t4时正逆反应速率都较原平衡时的速率大,反应向逆反应方向移动,升高温度;t6时正逆反应速率都较原平衡时的速率大,但平衡不移动,前后气体系数之和不等,只能是使用催化剂;在t4时反应向逆反应方向移动,则t3~t4时平衡混合物中CO的含量最高,
故答案为:升高温度;t3~t4;
点评 本题考查了盖斯定律的应用、化学平衡影响因素和平衡计算的分析判断,注意知识的迁移和应用是解题关键,难度不大.

| A. | 甲醛能使蛋白质变性,可用于食品防腐剂 | |
| B. | 炭具有还原性,一定条件下能将二氧化硅还原为硅 | |
| C. | 硅酸钠溶液呈碱性,常用作木材的防火剂 | |
| D. | Al2O3具有很高的熔点,可用于制造熔融烧碱的坩埚 |
| A. | Na+,OH-,K+,SO42- | B. | Ag+,K+,NO3-,CO32- | ||
| C. | K+,Cu2+,OH-,Cl- | D. | Na+,Ba2+,SO42-,Cl- |
| A. | AlCl3 | B. | NaAlO2 | C. | Al(OH)3 | D. | Na2CO3 |
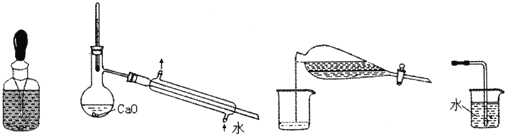
| A. | 储存液溴 | B. | 提纯含少量水的乙醇 | ||
| C. | 分离CCl4和水 | D. | 吸收氨气 |
| A. | 该反应前后氮元素的化合价不变 | |
| B. | 该反应中的四种物质晶体中都存在氢键 | |
| C. | 该反应中NH3、F2、NF3的分子中所有原子均共平面 | |
| D. | 该反应中NH3、F2、NF3三种物质的晶体均属于分子晶体 |
| A. | 原子核外电子排布--元素在周期表中的位置 | |
| B. | 弱电解质的相对强弱--电离常数的大小 | |
| C. | 分子间作用力的大小--分子稳定性的高低 | |
| D. | 物质内部储存的能量--化学反应的热效应 |
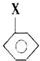 +CH2═CHCOOCH3$\stackrel{PdCl_{2}}{→}$
+CH2═CHCOOCH3$\stackrel{PdCl_{2}}{→}$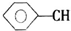 =CHCOOCH3+HX(X为卤素原子)
=CHCOOCH3+HX(X为卤素原子)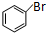 +CH2=CHCOOCH2CH3$\stackrel{PdCl_{2}}{→}$
+CH2=CHCOOCH2CH3$\stackrel{PdCl_{2}}{→}$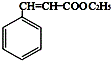 +HBr.
+HBr.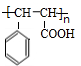 .
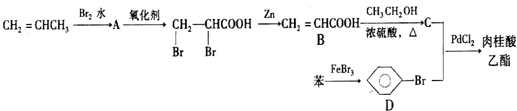
. 乙醇是生活中常见的有机物,能进行如图所示的多种反应,A,C,D都是有机物.
乙醇是生活中常见的有机物,能进行如图所示的多种反应,A,C,D都是有机物.