题目内容
6.硫铁矿是工业制硫酸的主要原料,某硫铁矿中含FeS2,假设杂质不参与反应,用酸性高锰酸钾溶液滴定法测定硫铁矿的纯度,其反应原理:FeS2+3MnO4-+8H+═3Mn2++Fe3++2SO42-+4H2O.取x g该样品磨成粉末滴加c mol•L-1酸性高锰酸钾溶液至恰好完全反应,消耗酸性高锰酸钾溶液V mL.则该样品的纯度为( )| A. | $\frac{cV}{x}$×100% | B. | $\frac{cV}{25x}$×100% | C. | $\frac{40cV}{x}$×100% | D. | $\frac{cV}{4x}$×100% |
分析 根据n=cV计算高锰酸钾的物质的量,根据方程式计算FeS2的物质的量,再根据m=nM计算FeS2的质量,进而计算样品的纯度.
解答 解:消耗高锰酸钾的物质的量为:V×10-3 L×cmol/L=Vc×10-3mol,
由FeS2+3MnO4-+8H+═3Mn2++Fe3++2SO42-+4H2O,可知FeS2的物质的量为$\frac{1}{3}$×Vc×10-3mol,
故样品的纯度为:[($\frac{1}{3}$×Vc×10-3mol×120g/mol)÷xg]×100%=$\frac{cV}{25x}$×100%,
故选B.
点评 本题考查化学方程式计算,比较基础,有利于基础知识的巩固.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.下列各组离子中,能在溶液中大量共存的是( )
| A. | Na+,OH-,K+,SO42- | B. | Ag+,K+,NO3-,CO32- | ||
| C. | K+,Cu2+,OH-,Cl- | D. | Na+,Ba2+,SO42-,Cl- |
17.NF3气体可由氨气和氟气反应得到:4NH3+3F2═NF3+3NH4F.下列有关说法中正确的是( )
| A. | 该反应前后氮元素的化合价不变 | |
| B. | 该反应中的四种物质晶体中都存在氢键 | |
| C. | 该反应中NH3、F2、NF3的分子中所有原子均共平面 | |
| D. | 该反应中NH3、F2、NF3三种物质的晶体均属于分子晶体 |
18.下列各组物质能用分液漏斗分离的是( )
| A. | 溴和苯 | B. | 溴和溴苯 | C. | 水和乙烷 | D. | 水和硝基苯 |
15.一般情况下,前者无法决定后者的是( )
| A. | 原子核外电子排布--元素在周期表中的位置 | |
| B. | 弱电解质的相对强弱--电离常数的大小 | |
| C. | 分子间作用力的大小--分子稳定性的高低 | |
| D. | 物质内部储存的能量--化学反应的热效应 |
15.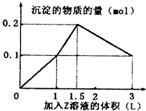 某混合溶液中,含溶质X、Y各0.1mol,向其中滴加0.1mol/L的Z溶液,所得沉淀的物质的量如图,则符合条件的X、Y、Z分别是( )
某混合溶液中,含溶质X、Y各0.1mol,向其中滴加0.1mol/L的Z溶液,所得沉淀的物质的量如图,则符合条件的X、Y、Z分别是( )
 某混合溶液中,含溶质X、Y各0.1mol,向其中滴加0.1mol/L的Z溶液,所得沉淀的物质的量如图,则符合条件的X、Y、Z分别是( )
某混合溶液中,含溶质X、Y各0.1mol,向其中滴加0.1mol/L的Z溶液,所得沉淀的物质的量如图,则符合条件的X、Y、Z分别是( )| A. | 偏铝酸钠、氢氧化钡、硫酸 | B. | 偏铝酸钠、氯化钡、硫酸 | ||
| C. | 氯化铝、氯化镁、氢氧化钠 | D. | 氯化铝、氯化铁、氢氧化钠 |
 乙醇是生活中常见的有机物,能进行如图所示的多种反应,A,C,D都是有机物.
乙醇是生活中常见的有机物,能进行如图所示的多种反应,A,C,D都是有机物.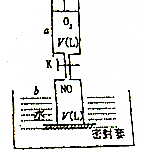 如图所示,活塞的质量与筒壁的摩擦不计,与K相连的细管的体积也忽略不计,在标准状况下:
如图所示,活塞的质量与筒壁的摩擦不计,与K相连的细管的体积也忽略不计,在标准状况下: