题目内容
【题目】工业上常用水钴矿(主要成分为Co2O3,还含少量Fe2O3、Al2O3、MgO、CaO等杂质)制备钴的氧化物,其制备工艺流程如下(已知Na2SO3能还原Fe3+和Co3+):
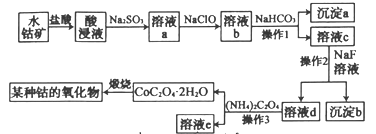
回答下列问题:
(1)在加入盐酸进行“酸浸”时,能提高“酸浸”速率的方法有______________(任写2种)。
(2)“酸浸”后加入Na2SO3钴的存在形式为Co2+,产生Co2+反应的离子方程式为________
(3)溶液a中加入NaClO的作用是___________________________________
(4)沉淀a的成分是__________(写化学式),操作2的名称是_______________
(5)溶液d中的金属离子只有Co2+和Na+两种,则溶液c中加入NaF溶液的作用是________
(6)在空气中缎烧CoC2O4生成钴的某种氧化物和CO2,测得充分煅烧后固体质量为12.05g,CO2的体积为6.72L(标准状况),则此反应的化学方程式为____________________________
【答案】将水钴矿石粉碎 ;充分搅拌;适当增加盐酸浓度;提高酸浸温度等 ![]() 将溶液中Fe2+氧化成Fe3+ Fe(OH)3、Al(OH)3 过滤 使Mg2+、Ca2+转化为难溶于水的MgF2、CaF2沉淀除去 3CoC2O4+2O2
将溶液中Fe2+氧化成Fe3+ Fe(OH)3、Al(OH)3 过滤 使Mg2+、Ca2+转化为难溶于水的MgF2、CaF2沉淀除去 3CoC2O4+2O2![]() Co3O4+6CO2
Co3O4+6CO2
【解析】
水钴矿中加入盐酸,可得CoCl3、FeCl3、AlCl3、MnCl2、MgCl2、CaCl2,浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等,则加入的Na2SO3将Co3+、Fe3+还原为Co2+、Fe2+;加入NaClO将Fe2+氧化为Fe3+,溶液b中阳离子有Co2+、Fe3+、Al3+、Mg2+、Ca2+,加入碳酸氢钠,Fe3+、Al3+与碳酸氢根离子发生相互促进的水解反应分别生成Fe(OH)3、Al(OH)3,故沉淀A的主要成分为Fe(OH)3、Al(OH)3;溶液c中含有Co2+、Mg2+、Ca2+,加入NaF,Mg2+、Ca2+转化成MgF2、CaF2沉淀,溶液d中含有Co2+,溶液d中加入草酸铵过滤得到CoC2O4晶体,最后煅烧得到钴的氧化物,据此分析作答。
(1)“酸浸”时为固体与液体的反应,根据外界条件对化学反应速率的影响,在加入盐酸进行“酸浸”时,能够提高“酸浸”速率的方法有:将水钴矿石粉碎,增大接触面积;充分搅拌;适当增加盐酸的浓度;适当提高酸浸的温度等,故答案为:将水钴矿石粉碎;充分搅拌;适当增加盐酸浓度;提高酸浸温度等。
(2)酸浸时水钴矿中的Co2O3、Fe2O3、Al2O3、MgO、CaO溶解转化为CoCl3、FeCl3、AlCl3、MgCl2、CaCl2;加入Na2SO3,钴的存在形式为Co2+,Co3+被还原为Co2+,则SO32-被氧化成SO42-,产生Co2+的反应可表示为:SO32-+Co3+→Co2++SO42-,根据得失电子守恒配平为:SO32-+2Co3+→2Co2++SO42-,根据溶液呈酸性和电荷守恒,生成Co2+的离子方程式为SO32-+2Co3++H2O=2Co2++SO42-+2H+;
(3)加入Na2SO3还会将Fe3+还原为Fe2+,反应的离子方程式为SO32-+2Fe3++H2O=2Fe2++SO42-+2H+;溶液a中含有Co2+、Fe2+、Al3+、Mg2+、Ca2+、Na+、Cl-、SO42-等,向溶液a中加入NaClO,NaClO具有强氧化性,将Fe2+氧化成Fe3+,反应的离子方程式为2Fe2++ClO-+2H+=2Fe3++Cl-+H2O,故答案为:将溶液中Fe2+氧化成Fe3+;
(4)加入NaClO溶液后得到的溶液b中含有Co2+、Fe3+、Al3+、Mg2+、Ca2+、Na+、Cl-、SO42-等;向溶液b中加入NaHCO3调节溶液的pH,使Fe3+、Al3+转化为氢氧化物沉淀而除去,沉淀A的成分为Fe(OH)3、Al(OH)3;溶液c中含有Co2+、Mg2+、Ca2+、Na+、Cl-、SO42-等,向溶液c中加入NaF,Mg2+、Ca2+转化为难溶于水的
(5)根据(4)的分析,溶液c中加入NaF溶液的作用是使Mg2+、Ca2+转化为难溶于水的MgF2、CaF2沉淀除去,故答案为:使Mg2+、Ca2+转化为难溶于水的MgF2、CaF2沉淀除去;
(6)n(CO2)=![]() =0.3mol,根据C守恒,n(CoC2O4)=0.15mol,根据Co守恒,n(Co)=0.15mol,所得钴的氧化物中n(O)=
=0.3mol,根据C守恒,n(CoC2O4)=0.15mol,根据Co守恒,n(Co)=0.15mol,所得钴的氧化物中n(O)=![]() =0.2mol,n(Co):n(O)=0.15mol:0.2mol=3:4,生成的钴的氧化物的化学式为Co3O4,在空气中煅烧CoC2O4的化学方程式为3CoC2O4+2O2
=0.2mol,n(Co):n(O)=0.15mol:0.2mol=3:4,生成的钴的氧化物的化学式为Co3O4,在空气中煅烧CoC2O4的化学方程式为3CoC2O4+2O2![]() Co3O4+6CO2。
Co3O4+6CO2。

【题目】下列实验操作、现象和结论均正确的是
选项 | 操作 | 现象 | 结论 |
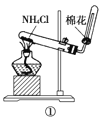
A | ①将湿润的红色石蕊试纸靠近试管口
| 试纸不变色 |
|
B | ②中振荡后静置 | 下层液体颜色变浅 |
|
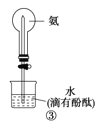
C | ③旋开活塞 | 观察到红色喷泉 |
|
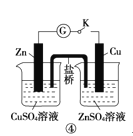
D | ④闭合开关K,形成原电池 | Zn极上有红色固体析出 | 锌的金属性比铜强 |
A.AB.BC.CD.D