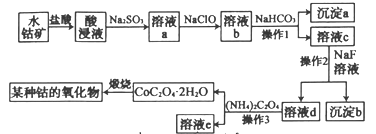
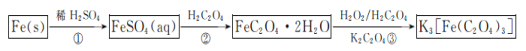题目内容
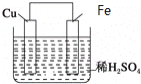
【题目】如图所示,常温下通电5 min后,发现铜电极的质量增加,试回答:
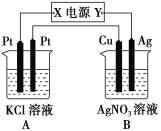
(1)电源电极X的名称为______(填“正极”或“负极”)。
(2)电解池B中阳极的电极反应式是:__________________________________________。
(3)若KCl溶液的体积是200 mL,则当铜电极的质量增加2.16 g时A中溶液的pH=________(忽略电解前后溶液体积的变化),若要使电解后的溶液恢复
到与电解前完全相同的状态,则应加入________(填物质的种类及物质的量)。
(4)当铜、银两电极的质量差为2.16 g时,A中生成的气体最多为________ mol。
【答案】负极 Ag-e-=Ag+ 13 0.02 mol HCl 0.01
【解析】
(1)B装置的铜电极质量增加,说明铜极上有金属析出,即溶液中的银离子被还原生成银单质,故铜极为阴极,由此可确定X极为负极,故答案为:负极;
(2)阳极上的银失去电子变成银离子,电极反应式为:Ag-e-=Ag+,故答案为:Ag-e-=Ag+;
(3)A装置是电解KCl溶液,阴极析出氢气,阳极析出氯气,溶液中氢氧根离子浓度增大;n(Ag)=![]() =0.02mol,转移电子数为0.02mol,则电路中有0.02mole-通过,A中生成的KOH为0.02mol,c(OH-)=
=0.02mol,转移电子数为0.02mol,则电路中有0.02mole-通过,A中生成的KOH为0.02mol,c(OH-)=![]() =0.1mol·L-1,c(H+)=
=0.1mol·L-1,c(H+)=![]() ,则pH=-lgc(H+)=13,当转移电子数为0.02mol时,生成0.01molH2和 0.01molCl2,相当于0.02molHCl,为使溶液恢复到电解前的状态,应加入0.02molHCl;故答案为:13;0.02 mol HCl;
,则pH=-lgc(H+)=13,当转移电子数为0.02mol时,生成0.01molH2和 0.01molCl2,相当于0.02molHCl,为使溶液恢复到电解前的状态,应加入0.02molHCl;故答案为:13;0.02 mol HCl;
(4)当铜银两电极质量差为2.16g时,表明铜电极上生成了0.01molAg,银电极溶解了0.01molAg,此时电路中有0.01mole-通过,根据2H++2e-=H2↑、2Cl--2e-=Cl2↑知,转移0.01mol时生成的氢气、氯气各0.005mol,则A中生成的氢气、氯气共为0.01mol,故答案为:0.01。

 阅读快车系列答案
阅读快车系列答案