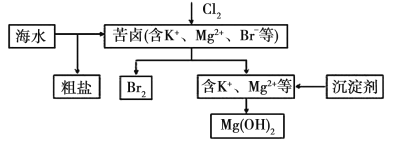
题目内容
【题目】某温度下,向体积为2L的恒容密闭容器中通入2molN2和6molH2,在一定条件下发生反应:N2(g)+3H2(g)![]() 2NH3(g)。实验测得反应经5min后达到平衡,此时混合物的总物质的量为5.6mol,求:
2NH3(g)。实验测得反应经5min后达到平衡,此时混合物的总物质的量为5.6mol,求:
(1)平衡时NH3的浓度为___mol·L-1。
(2)0~5min内,v(H2)=___mol·L-1·min-1。
(3)反应达到平衡时,N2的转化率为___。
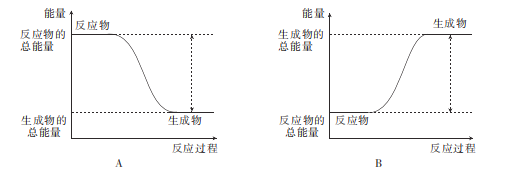
(4)下列图象中能反映该反应的能量变化的是___(填标号)。
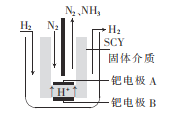
(5)若以N2和H2合成氨的反应设计如图所示的原电池,则通入N2的一极为__(填“正”或“负")极;负极的电极反应式为___。
【答案】1.2 0.36 60%(或0.6) A 正 H2-2e-=2H+
【解析】
对于合成氨反应,可假设N2的物质的量的变化量,并由此建立三段式,然后利用混合气的总量,求出各物质的变化量和平衡量,从而求出速率、反应物的转化率及平衡浓度等;合成氨反应为放热反应,反应物的总能量高于生成物的总能量;若将合成氨反应设计成原电池,则通N2的电极作正极,通H2的电极作负极,酸作电解质溶液。
设参加反应N2的物质的量为x,从而建立如下三段式;
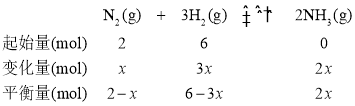
2-x+6-3x+2x=5.6,x=1.2mol。
(1)平衡时NH3的浓度为![]() =1.2mol·L-1。答案为:1.2;
=1.2mol·L-1。答案为:1.2;
(2)0~5min内,v(H2)= = 0.36mol·L-1·min-1。答案为:0.36;
= 0.36mol·L-1·min-1。答案为:0.36;
(3)反应达到平衡时,N2的转化率为![]() =60%(或0.6)。答案为:60%(或0.6);
=60%(或0.6)。答案为:60%(或0.6);
(4)合成氨反应是一个放热反应,反应物的总能量大于生成物的总能量,对照图中反应物与生成物的能量关系,可确定答案为A。答案为:A;
(5)若以N2和H2合成氨的反应设计如图所示的原电池,则N2得电子,通入正极,H2失电子,通入负极,则通入N2的一极为正极;电解质为酸,所以负极的电极反应式为H2-2e-=2H+。答案为:正;H2-2e-=2H+。

【题目】某小组在验证反应“Fe+2Ag+=Fe2++2Ag”的实验中检测到Fe3+,发现和探究过程如下。
向硝酸酸化的0.05mol·L-1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
(1)检验产物
①取出少量黑色固体,洗涤后,__(填操作和现象),证明黑色固体中含有Ag。
②取上层清液,滴加K3Fe(CN)6溶液,产生蓝色沉淀,说明溶液中含有__。
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是__(用离子方程式表示)。针对两种观点继续实验:
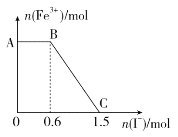
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测。同时发现有白色沉淀产生,且溶液颜色深浅、沉淀量多少与取样时间有关,对比实验记录如下:
序号 | 取样时间/min | 现象 |
ⅰ | 3 | 产生大量白色沉淀;溶液呈红色 |
ⅱ | 30 | 产生白色沉淀;较3min时量少;溶液红色较3min时加深 |
ⅲ | 120 | 产生白色沉淀;较30min时量少;溶液红色较30min时变浅 |
(资料:Ag+与SCN-生成白色沉淀AgSCN)
②对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2,由于__(用离子方程式表示),可产生Fe3+;
假设c:酸性溶液中NO3-具有氧化性,可产生Fe3+;
假设d:根据__现象,判断溶液中存在Ag+,可产生Fe3+。
③下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因。实验Ⅱ可证实假设d成立。
实验Ⅰ:向硝酸酸化的__溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3min时溶液呈浅红色,30min后溶液几乎无色。
实验Ⅱ:装置如图。其中甲溶液是__,操作及现象是__。
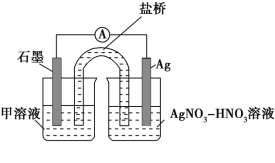
(3)根据实验现象,结合方程式推测实验ⅰ~ⅲ中Fe3+浓度变化的原因:__。