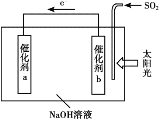
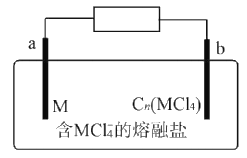
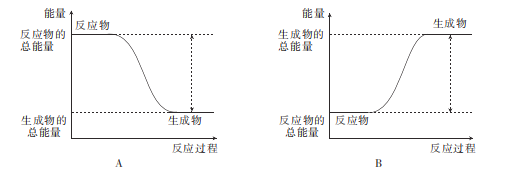
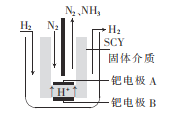
题目内容
【题目】400℃时,将一定量的SO2和14molO2压入一个盛有催化剂的10L密闭容器中进行反应:2SO2+O22SO3。已知2min时,容器中剩余2molSO2和12molO2。试计算:
(1)SO2的起始物质的量浓度__________________。
(2)2min内SO3的反应速率____________________。
【答案】0. 6 mol·L-1 0. 2 mol·L-1·min-1
【解析】
先计算出氧气的浓度的变化量,根据变化量之比等于化学计量数之比计算出SO2 和SO3的浓度的变化量,再用三段法进行计算。
根据c=![]() ,开始时容器内有14molO2,O2的物质的量浓度为1. 4 mol·L-1,2min时容器中剩余2molSO2和12molO2,,2min时容器中剩余SO2和O2物质的量浓度分别为:0. 2 mol·L-1,1. 2 mol·L-1,设SO2的起始物质的量浓度为x,根据变化量之比等于化学计量数之比,写出该反应的三段式如下:
,开始时容器内有14molO2,O2的物质的量浓度为1. 4 mol·L-1,2min时容器中剩余2molSO2和12molO2,,2min时容器中剩余SO2和O2物质的量浓度分别为:0. 2 mol·L-1,1. 2 mol·L-1,设SO2的起始物质的量浓度为x,根据变化量之比等于化学计量数之比,写出该反应的三段式如下:

SO2的起始物质的量浓度x=0. 2 mol·L-1+0. 4 mol·L-1=0. 6 mol·L-1;2min内SO3的反应速率v=![]() =0. 2 mol·L-1·min-1,答案为:0. 6 mol·L-1;0. 2 mol·L-1·min-1。
=0. 2 mol·L-1·min-1,答案为:0. 6 mol·L-1;0. 2 mol·L-1·min-1。

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目