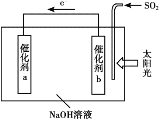
题目内容
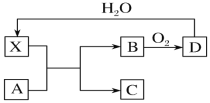
【题目】海水开发利用的部分过程如图所示。下列相关说法错误的是( )
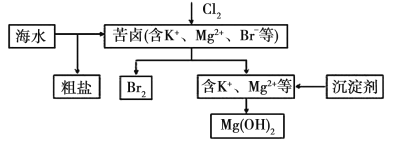
A.将氯气通入苦卤中发生反应的离子方程式为Cl2+2Br-=2Cl-+Br2
B.可以通过物理方法从海水中得到粗盐
C.生产中用NaOH作为沉淀剂获得Mg(OH)2
D.用空气和水蒸气吹出单质溴,再用SO2将其还原吸收,以达到富集溴的目的
【答案】C
【解析】
海水蒸发结晶后过滤得到粗盐和苦卤,苦卤中通入氯气将溴离子氧化成溴单质,分离得到溴单质,剩余溶液中主要含K+、Mg2+、Cl-,加入生石灰或石灰乳得到氢氧化镁沉淀。
A.据图可知苦卤中含有溴离子,通入氯气得到了溴单质,离子方程式为Cl2+2Br-=2Cl-+Br2,故A正确;
B.通过蒸发结晶可以从海水中得到粗盐,该过程为物理变化过程,故B正确;
C.NaOH成本较高,工业生产中常用较为廉价的生石灰或石灰乳作沉淀剂,故C错误;
D.海水中溴含量较低,氯气氧化得到的溴单质浓度较低,用空气和水蒸气吹出单质溴,再用SO2将其还原吸收,可以达到富集的目的,故D正确;
故答案为C。

 一线名师提优试卷系列答案
一线名师提优试卷系列答案【题目】硫酸是重要的化工原料,工业制取硫酸最重要的一步反应为:2SO2(g)+O2(g) ![]() 2SO3(g) △H< 0
2SO3(g) △H< 0
(1)为提高SO2的转化率,可通入过量O2,用平衡移动原理解释其原因:___________。
(2)某兴趣小组在实验室对该反应进行研究,部分实验数据和图像如下。
反应条件:催化剂、一定温度、容积10 L
实验 | 起始物质的量/mol | 平衡时SO3 物质的量/mol | ||
SO2 | O2 | SO3 | ||
ⅰ | 0.2 | 0.1 | 0 | 0.12 |
ⅱ | 0 | 0 | 0.2 | a |
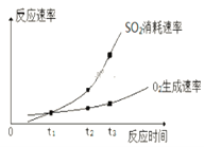
①实验ⅰ中SO2的转化率为______。
②a____0.12(填“>”、“=”或“<”)。
③t1、t2、t3中,达到化学平衡状态的是________。
④ t2到t3的变化是因为改变了一个反应条件,该条件可能是___________。
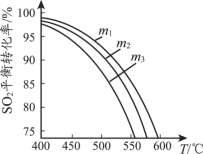
(3)将SO2和O2充入恒压密闭容器中,原料气中SO2 和O2的物质的量之比m(m=n(SO2)/n(O2))不同时,SO2的平衡转化率与温度(T)的关系如下图所示,则m1、m2、m3的大小顺序为_____。