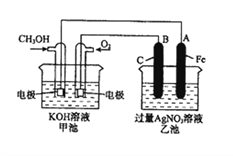
题目内容
【题目】溴化镁(MgBr2)可由金属镁在室温下与干燥后的溴在乙醚中反应制得,利用如图所示装置制备溴化镁,并测定其产率。已知:
①Mg和Br2反应剧烈且放热,MgBr,2具有强吸水性;
②MgBr2+3C2H5OC2H5=MgBr2·3C2H5OC2H5.
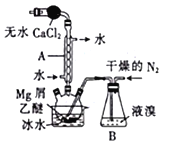
(1)保存液溴时在瓶内加入适量的蒸馏水,其目的是___________。
(2)球形干燥管中放入无水CaCl2的作用是______________,仪器A的名称是________。
(3)实验时,应缓慢通入干燥的氮气,直至溴完全导入三颈烧瓶中。如果将所用液溴一次性全部加入三颈烧瓶中,其后果是___________________。
(4)反应完毕后恢复至室温过滤,将滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得到三乙醚合溴化镁(MgBr2·3C2H5OC2H5)粗品。第一次过滤得到的固体物质是_______。
(5)常温下用苯溶解粗品,冷却至0℃,析出晶体,经操作a得到三乙醚合溴化镁,加热至160℃分解得到无水MgBr2产品。
①操作a是________________。
②写出三乙醚合溴化镁加热至160℃分解得无水MgBr2的化学方程式:_______________。
(6)反应开始前装入5.0g镁屑和150mL无水乙醚,无水MgBr2在干燥器中冷却到室温后,称量,其质量为29.8g。则该实验制取MgBr2的产率是__________(保留一位小数)。
【答案】 防止液溴挥发 防止空气中的水蒸气进入反应装置 球形冷凝管 反应过于剧烈,使反应过程难以控制 镁屑 过滤、洗涤 MgBr2·3C2H5OC2H5 ![]() MgBr2+3C2H5OC2H5 77.7%
MgBr2+3C2H5OC2H5 77.7%
【解析】(1)液溴易挥发,所以在保存液溴时在瓶内加入适量的蒸馏水,使挥发出来的溴蒸气溶解在蒸馏水中,防止液溴挥发,故答案为:防止液溴挥发。
(2)MgBr2具有强吸水性,所以反应在无水环境下进行,无水CaCl2可以吸水,防止空气中的水分进入;仪器A为球形冷凝管,故答案为:防止空气中的水蒸气进入反应装置;球形冷凝管。
(3)向锥形瓶中通入氮气,瓶中压强增大,将液溴导入反应装置。若将所用液溴一次性全部加入三颈烧瓶中,反应过于剧烈,使反应过程难以控制,所以通入氮气的速率不能过快。故答案为:反应过于剧烈,使反应过程难以控制。
(4)反应完毕后恢复至室温,过滤除去的固体为未反应完的镁屑,故答案为:镁屑。
(5)①再析出晶体之后,经过过滤、洗涤即可得到晶体三乙醚合溴化镁,故答案为:过滤、洗涤。
②三乙醚合溴化镁加热至160℃分解得到无水MgBr2产品,再根据已知信息“MgBr2+3C2H5OC2H5=MgBr2·3C2H5OC2H5”可知MgBr2·3C2H5OC2H5分解的方程式为:MgBr2·3C2H5OC2H5![]() MgBr2+3C2H5OC2H5,故答案为:MgBr2·3C2H5OC2H5
MgBr2+3C2H5OC2H5,故答案为:MgBr2·3C2H5OC2H5![]() MgBr2+3C2H5OC2H5。
MgBr2+3C2H5OC2H5。
(6)根据Mg~MgBr2,理论上生成的m(MgBr2)= ![]() =38.35g,则该实验制取MgBr2的产率为
=38.35g,则该实验制取MgBr2的产率为![]() =77.7%,故答案为77.7%.
=77.7%,故答案为77.7%.