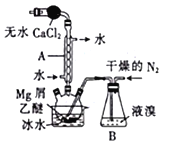
题目内容
【题目】硝酸镓在激光材料的制备中已成为重要的基础和主要原料。以废催化剂GCS(主要成分为Ga2O3、Cr2O3和SiO2)为原料制备硝酸嫁晶体的工艺流程如下:

(1)滤渣的主要成分是______(写化学式),用稀氨水调节溶液pH至3.0~3.5之间的目的是________。
(2)用硝酸溶解时,温度应控制在40~80℃,实验室控制该温度区间的方法是______;温度高于80℃,溶解速率减慢,其原因是____________。
(3)采用减压蒸馏的目的是_________________。
(4)催化剂GCS可用于催化热乙烯还原一氧化氮,以消除尾气排放对大气的污染,写出该反应的化学方程式:________________。
(5)用硝酸镓制备含镓、铱和铂的催化剂可以有效地催化正庚烷转化为甲苯,该反应的化学方程式为________________。
(6)硝酸镓晶体加热过程中,固体失重率[失重率=![]() ]随温度的变化关系如图所示。A点时,固体物质的化学式为_________,B点至C点变化过程中,生成的气体为N2O5和另一种氮氧化物,则该变化的总反应方程式为___________。
]随温度的变化关系如图所示。A点时,固体物质的化学式为_________,B点至C点变化过程中,生成的气体为N2O5和另一种氮氧化物,则该变化的总反应方程式为___________。

【答案】 SiO2 使Ga3+水解完全生成Ga(OH)3 水浴加热 硝酸受热易挥发且会分解 使过量硝酸和水蒸气快速蒸出 C2H4+6NO ![]() 3N2+2CO2+2H2O CH3CH2CH2CH2CH2CH2CH3
3N2+2CO2+2H2O CH3CH2CH2CH2CH2CH2CH3![]()
 +4H2↑ 2Ga(NO3)3·3H2O Ga(NO3)3
+4H2↑ 2Ga(NO3)3·3H2O Ga(NO3)3![]() GaO2+NO2↑+N2O5↑
GaO2+NO2↑+N2O5↑
【解析】流程分析:该工艺流程的目的为以废催化剂GCS(主要成分为Ga2O3、Cr2O2和SiO2)为原料制备硝酸镓晶体,所以流程中要先将Cr、Si等杂质除去。第一步,盐酸酸浸,Ga2O3和Cr2O3溶于盐酸,而SiO2不溶于盐酸,过滤后得到滤渣的主要成分为SiO2,滤液中溶质主要为GaCl3、CrCl3和未反应完的盐酸。第二步,加入稀氨水调pH,根据流程可知,加氨水后得到Ca(OH)3沉淀,而Cr3+进入滤液,从而达到分离Cr与Ga的目的。第三步,向Ca(OH)3沉淀中加入硝酸,使其溶解,所得溶液主要溶质为Ca(NO3)3和未反应完的硝酸,再进行减压蒸馏、冷却干燥后得到目标产物。
(1)根据上述分析,滤渣的主要成分为SiO2。用稀氨水调节溶液pH至3.0~3.5之间的目的是使Ga3+水解完全生成Ga(OH)3。故答案为:SiO2;使Ga3+水解完全生成Ga(OH)3。
(2)若要将温度控制在40~80℃,可采用水浴加热的方式控制温度。温度太低,硝酸反应速度较慢,若温度高于80℃,硝酸受热易挥发且会分解,沉淀溶解的速率也会减慢。故答案为:水浴加热;硝酸受热易挥发且会分解。
(3)溶液中主要溶质为Ca(NO3)3和未反应完的硝酸,减压蒸馏可以降低硝酸和水的沸点,加快硝酸和水蒸气的蒸出,故答案为:使过量硝酸和水蒸气快速蒸出。
(4)根据题意可知,乙烯和NO在GCS作催化剂的条件下,反应生成无污染的N2和CO2,反应方程式为C2H4+6NO![]() 3N2+2CO2+2H2O,故答案为:C2H4+6NO
3N2+2CO2+2H2O,故答案为:C2H4+6NO![]() 3N2+2CO2+2H2O。
3N2+2CO2+2H2O。
(5)在催化剂的作用下,正庚烷可转化为甲苯,根据原子守恒可知,应还有H2生成,故反应方程式为CH3CH2CH2CH2CH2CH2CH3![]()
 +4H2↑。
+4H2↑。
(6)Ga(NO3)3﹒9H2O的相对分子质量为418,假设加热前硝酸镓晶体的质量为418g,物质的量为1mol,则其中结晶水的质量=18g×9=162g。A点时,失重率为32.3%,则固体减少的质量△m=418×32.3%=135g,所以A点固体物质中还含有结晶水。A点固体中结晶水的物质的量= ![]() =1.5mol,则固体中n[Ga(NO3)3]﹕n[结晶水]=1﹕1.5=2﹕3,所以A点固体物质的化学式为2Ga(NO3)3·3H2O。
=1.5mol,则固体中n[Ga(NO3)3]﹕n[结晶水]=1﹕1.5=2﹕3,所以A点固体物质的化学式为2Ga(NO3)3·3H2O。
B点时,失重率为38.7%,则固体减少的质量=418×38.7%≈162g,则B点时恰好失去全部结晶水,固体物质的化学式为Ga(NO3)3。C点时,失重率为75.6%,则固体减少的质量=418×75.6%=316g,剩余固体的质量=102g,其中m(Ga)=70g。B点至C点变化过程中,生成的气体为N2O5和另一种氮氧化物,则可推测剩余固体为Ga的氧化物,且m(O)=32g,所以固体物质中n(Ga)﹕n(O)= 1﹕2,则固体物质的化学式为GaO2。GaO2中Ga元素化合价为+4价,则GaO2为氧化产物,另一种氮氧化物应为还原产物。假设该氮氧化物为NO2,则有Ga(NO3)3——GaO2+NO2↑+N2O5↑,根据化合价升价守恒和原子守恒,可得方程式Ga(NO3)3 ![]() GaO2+NO2↑+N2O5↑,假设成立。
GaO2+NO2↑+N2O5↑,假设成立。
故答案为:2Ga(NO3)3·3H2O;Ga(NO3)3![]() GaO2+NO2↑+N2O5↑。
GaO2+NO2↑+N2O5↑。

【题目】根据下列事实,完成相关的离子方程式或化学式,必要时可加一定文字说明:
(1)硫酸铝钾[明矾KAl(SO4)2·12H2O]可以作净水剂_____________________。
(2)泡沫灭火器的化学原理________________________________________________。
(3)热的纯碱溶液清洗油污___________________________________________。
(4)加热蒸干FeCl2水溶液并灼烧,得到物质的化学式为___________。
【答案】 Al3++3H2O![]() Al(OH)3(胶体)+3H+ Al3++3HCO3-=Al(OH)3↓+3CO2↑ CO32-+H2O
Al(OH)3(胶体)+3H+ Al3++3HCO3-=Al(OH)3↓+3CO2↑ CO32-+H2O![]() HCO3-+OH-,加热可以促进水解,溶液碱性增强 Fe2O3
HCO3-+OH-,加热可以促进水解,溶液碱性增强 Fe2O3
【解析】(1)明矾净水的原理是氯离子水解得到氢氧化铝胶体,胶体吸附水中杂质,所以离子方程式为:Al3++3H2O![]() Al(OH)3(胶体)+3H+。
Al(OH)3(胶体)+3H+。
(2)泡沫灭火器中加入的是碳酸氢钠和硫酸铝,利用其双水解反应,离子方程式为:Al3++3HCO3-=Al(OH)3↓+3CO2↑。
(3)热的纯碱溶液清洗油污是利用碳酸钠水解得到的碱与油污发生皂化反应,以除去油污,加热是为了促进碳酸根离子的水解,增强溶液的碱性。反应为:CO32-+H2O![]() HCO3-+OH-。
HCO3-+OH-。
(4)加热蒸干FeCl2水溶液并灼烧,氯化亚铁水解得到氢氧化亚铁和HCl,因为HCl挥发,所以水解平衡移动,得到的氢氧化亚铁被氧化为氢氧化铁,分解得到氧化铁。
【题型】填空题
【结束】
19
【题目】实验题
(一)实验室中有一瓶含有一定量杂质的烧碱样品,某学生用中和滴定法测定烧碱的纯度,若烧碱中所含杂质与酸不反应,请根据实验回答:
(1)将准确称取的5g烧碱样品配成100 mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒、托盘天平外,还必须用到的玻璃仪器有:____________、_____________。
(2)取10.00 mL待测液,选择右图中_________(填A或B)来移取。

(3)用0.5000mol/L标准盐酸滴定待测烧碱溶液,以酚酞为指示剂。滴定时左手旋转滴定管玻璃活塞,右手不停地摇动锥形瓶,两眼注视___________,直到滴定终点。滴定达到终点的标志是:_________。
(4)根据下列数据,烧碱的纯度为:_______________________(纯度=纯物质的质量/样品的质量×100%)
滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 10.00 | 0.50 | 20.40 |
第二次 | 10.00 | 4.00 | 24.10 |
(二)氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:
<>①可将2mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成 CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20mL l.0×l0﹣4 mol/L的KMnO4溶液。
(1)写出用KMnO4滴定H2C2O4的离子方程式_____________________。
(2)滴定时,将KMnO4溶液装在________(填“酸式”或“碱式”)滴定管中。
(3)计算:血液中含钙离子的浓度为_____mol·L-1。