题目内容
【题目】右图是一个化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O。
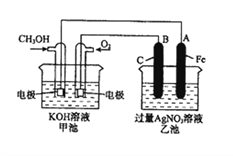
(1)请回答图中甲、乙两池的名称。甲池是________装置,乙池是________装置。
(2)请回答下列电极的名称:通入CH3OH的电极名称是__________________,B(石墨)电极的名称是______________________。
(3)写出电极反应式:通入O2的电极的电极反应式是__________________。A(Fe)电极的电极反应式为_______________________________________。
(4)乙池中反应的化学方程式为________________________________________。
(5)当乙池中A(Fe)极的质量增加4.32g时,甲池中理论上消耗O2__________mL(标准状况下)。
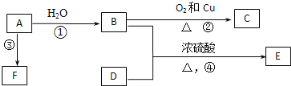
【答案】 原电池(化学能转变为电能) 电解池(电能转变为化学能) 负极 阳极 O2+2H2O+4e- =4OH- 4Ag++4e-=4Ag 4AgNO4+2H2O![]() 4Ag+O2↑+4HNO3 224
4Ag+O2↑+4HNO3 224
【解析】(1)从图中可以看出甲池是燃料电池,即化学能转化为电能的装置,因此甲池是原电池,乙池为电解池;
(2)通入甲醇的电极为负极,通入氧气的电极为正极;铁棒与甲醇电极相连,铁被保护,所以A(铁棒)是阴极,B(石墨)是阳极;
(3)通入氧气的电极是正极,在碱性环境下的电极反应为:O2+2H2O+4e- =4OH-;A(Fe)电极为阴极,在硝酸银溶液中该电极的电极反应为4Ag++4e-=4Ag;
(4)乙池是电解池,阳极的电极反应为4OH--4e- =O2↑+2H2O,阴极的电极反应为4Ag++4e-=4Ag,电解硝酸银溶液,电解总反应的化学方程式为4AgNO4+2H2O![]() 4Ag+O2↑+4HNO3;
4Ag+O2↑+4HNO3;
(5)当乙池中A(Fe)极的质量增加4.32 g Ag,生成银的物质的量为0.04 mol,转移电子的物质的量为0.04 mol,根据电子守恒,消耗O2的物质的量为0.01 mol,在标况下,消耗O2的体积为0.224 L,即224 mL。

 阅读快车系列答案
阅读快车系列答案【题目】已知:4HCl(g)+O2(g)2Cl2(g)+ 2H2O(g),该反应放出123kJ/mol的热量。其中相关的化学键键能数据如下:其中a的值为
化学键 | H—Cl | O=O | Cl—Cl | H—O |
E/(kJ/mol) | 431 | 497 | a | 465 |
A.242B.303.5C.180.5D.365