题目内容
11.水溶液中能大量共存的一组离子是( )| A. | Mg2+、Ag+、NO3-、SO42- | B. | Fe3+、Cu2+、SO32-、ClO- | ||
| C. | Na+、K+、AlO2-、OH- | D. | Ca2+、H+、C6H5O-、I- |
分析 A.硫酸根离子与银离子反应生成硫酸银沉淀;
B.铁离子、次氯酸根离子能够氧化亚硫酸根离子,铜离子与亚硫酸根离子、次氯酸根离子发生反应;
C.四种离子之间不满足离子反应发生反应;
D.氢离子与C6H5O-反应生成苯酚.
解答 解:A.Ag+、SO42-之间发生反应,在溶液中不能大量共存,故A错误;
B.SO32-与Fe3+、ClO-之间都发生氧化还原反应,Fe3+、Cu2+都与ClO-发生双水解反应,在溶液中不能大量共存,故B错误;
C.Na+、K+、AlO2-、OH-之间不发生反应,在溶液中能够大量共存,故C正确;
D.H+、C6H5O-之间反应生成苯酚,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的正误判断,为高考的高频题,属于中等难度的试题,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间,能发生络合反应的离子之间(如 Fe3+和 SCN-)等;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识的能力.

练习册系列答案
相关题目
1.下列过程属于物理变化的是( )
| A. | 平行光照射胶体产生丁达尔现象 | B. | 紫外线照射下,液态蛋白质凝固 | ||
| C. | 电解质溶液导电过程 | D. | 铁遇到冷的浓硝酸溶液发生钝化 |
2.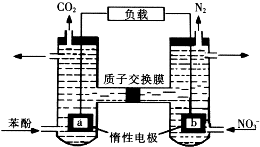 我国科学家构建了一种双室微生物燃料电池,以苯酚(C6H6O)为燃料,同时消除酸性废水中的硝酸盐.下列说法正确的是
我国科学家构建了一种双室微生物燃料电池,以苯酚(C6H6O)为燃料,同时消除酸性废水中的硝酸盐.下列说法正确的是
( )
 我国科学家构建了一种双室微生物燃料电池,以苯酚(C6H6O)为燃料,同时消除酸性废水中的硝酸盐.下列说法正确的是
我国科学家构建了一种双室微生物燃料电池,以苯酚(C6H6O)为燃料,同时消除酸性废水中的硝酸盐.下列说法正确的是( )
| A. | a为正极 | |
| B. | 左池电极反应式为C6H6O+11H2O-28e-=6CO2↑+28H+ | |
| C. | 若右池产生0.672L气体(标况下),则转移电子0.15mol | |
| D. | 左池消耗的苯酚与右池消耗的NO${\;}_{3}^{-}$的物质的量之比为28:5 |
19.已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp[Ag2CrO4(砖红色)]=9.0×10-12,下列说法不正确的是( )
| A. | 温度相同时,溶解度大小顺序为S(Ag2CrO4)>S(AgCl)>S(AgBr) | |
| B. | 往含Cl-,Br-,CrO42-浓度均为0.01mol•L-1溶液中滴加0.01mol•L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为Br-、CrO42-、Cl- | |
| C. | 用滴定法测KNO3溶液中KCl的含量时,可选择用AgNO3溶液做标准液,Ag2CrO4溶液做指示剂 | |
| D. | 1.88gAgBr投入到100mol/LNaCl溶液中有AgCl |
6.下列装置能达到相应实验目的是( )
| A. | 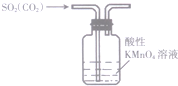 除去SO2中混有的CO2 | B. | 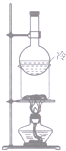 分离NH4Cl和Ca(OH)2固体 | ||
| C. | 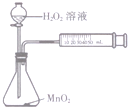 测定O2的生成速率 | D. | 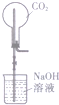 喷泉实验 |
16.下列有关电解质溶液中微粒的关系正确的是( )
| A. | 25℃时,pH=4的氯化铵溶液中:c(NH4+)>c(Cl-)>c(H+)>c(OH-) | |
| B. | 25℃时,pH=3的氯化铵溶液中:c(OH-)=1.0×10-3mol•L-1 | |
| C. | 将pH=5的醋酸溶液稀释后,恢复至原温度,pH和Kw均增大 | |
| D. | 向NH4HSO4溶液中加入等物质的量的NaOH形成的溶液中:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
1.第ⅤA族元素中的A、B两种元素所在周期分别最多可排18和8种元素,且B在A的上一周期,当A的原子序数为x时,B的原子序数为( )
| A. | x-18 | B. | x-8 | C. | x+8 | D. | x+18 |
18.用括号内的试剂除去下列各物质中少量的杂质,正确的是( )
| A. | 溴苯中的溴(碘化钾溶液) | B. | 硝基苯中溶有NO2(氢氧化钠溶液) | ||
| C. | 乙醇中的乙酸(饱和碳酸钠溶液) | D. | 苯中的苯酚(溴水) |
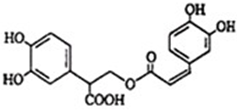 迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如图.请写出迭香酸中所有官能团的名称羧基、酯基、(酚)羟基、碳碳双键.
迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如图.请写出迭香酸中所有官能团的名称羧基、酯基、(酚)羟基、碳碳双键.