题目内容
2.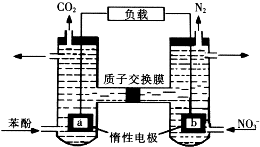 我国科学家构建了一种双室微生物燃料电池,以苯酚(C6H6O)为燃料,同时消除酸性废水中的硝酸盐.下列说法正确的是
我国科学家构建了一种双室微生物燃料电池,以苯酚(C6H6O)为燃料,同时消除酸性废水中的硝酸盐.下列说法正确的是( )
| A. | a为正极 | |
| B. | 左池电极反应式为C6H6O+11H2O-28e-=6CO2↑+28H+ | |
| C. | 若右池产生0.672L气体(标况下),则转移电子0.15mol | |
| D. | 左池消耗的苯酚与右池消耗的NO${\;}_{3}^{-}$的物质的量之比为28:5 |
分析 该原电池中,硝酸根离子得电子发生还原反应,则右边装置中电极b是正极,电极反应式为2NO3-+10e-+12H+=N2↑+6H2O,左边装置电极a是负极,负极上C6H6O失电子发生氧化反应生成二氧化碳,电极反应式为C6H6O+11H2O-28e-=6CO2↑+28H+,据此分析解答.
解答 解:该原电池中,硝酸根离子得电子发生还原反应,则右边装置中电极b是正极,电极反应式为2NO3-+10e-+12H+=N2↑+6H2O,左边装置电极a是负极,负极上C6H6O失电子发生氧化反应生成二氧化碳,电极反应式为C6H6O+11H2O-28e-=6CO2↑+28H+,
A.该原电池中,左边装置电极a是负极,故A错误;
B.左边装置电极a是负极,负极上C6H6O失电子发生氧化反应生成二氧化碳,电极反应式为C6H6O+11H2O-28e-=6CO2↑+28H+,故B正确;
C.右边装置中电极b是正极,电极反应式为2NO3-+10e-+12H+=N2↑+6H2O,产生0.672L气体(标况下),则转移电子$\frac{0.672L}{22.4L/mol}$×10=0.3mol,故C错误;
D.放电时,右边装置中电极b是正极,电极反应式为2NO3-+10e-+12H+=N2↑+6H2O,左边装置电极a是负极,电极反应式为C6H6O+11H2O-28e-=6CO2↑+28H+,根据得失电子守恒,则消耗的苯酚与右池消耗的NO3-的物质的量之比为5:28,故D错误;
故选B.
点评 本题考查化学电源新型电池,侧重考查学生获取信息、分析推断能力,根据N元素化合价变化确定正负极,难点是电极反应式的书写,且原电池和电解池原理是高考高频点,要熟练掌握.

练习册系列答案
相关题目
13.利用下列实验器材(规格和数量不限,夹持仪器不限),不能完成相应实验的选项是( )
| 实验器材(省略夹持装置) | 相应实验 | |
| A | 烧杯、锥形瓶、试管、温度计 | 探究温度对H2SO4和Na2S2O3反应速率的影响 |
| B | 烧杯、玻璃棒、胶头滴管、漏斗、滤纸 | 用盐酸除去硫酸钡中的少量碳酸钡 |
| C | 烧杯、玻璃棒、胶头滴管、容量瓶、电子天平 | 用固体氯化钠配制100mL0.5mol•L-1的溶液 |
| D | 烧杯、玻璃棒、胶头滴管、分液漏斗 | 用溴水和CCl4除去NaBr溶液中的少量NaI |
| A. | A | B. | B | C. | C | D. | D |
10.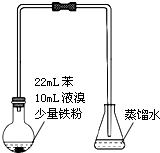 溴苯是不溶于水的液体,常温下不与酸、碱反应,可用如图装置制取(该反应放出热量).制取时观察到烧瓶中有大量红棕色蒸气,锥形瓶中导管口有白雾出现等现象.
溴苯是不溶于水的液体,常温下不与酸、碱反应,可用如图装置制取(该反应放出热量).制取时观察到烧瓶中有大量红棕色蒸气,锥形瓶中导管口有白雾出现等现象.
 +Br2$\stackrel{铁屑}{→}$
+Br2$\stackrel{铁屑}{→}$ +HBr
+HBr
下列说法错误的是( )
 溴苯是不溶于水的液体,常温下不与酸、碱反应,可用如图装置制取(该反应放出热量).制取时观察到烧瓶中有大量红棕色蒸气,锥形瓶中导管口有白雾出现等现象.
溴苯是不溶于水的液体,常温下不与酸、碱反应,可用如图装置制取(该反应放出热量).制取时观察到烧瓶中有大量红棕色蒸气,锥形瓶中导管口有白雾出现等现象. +Br2$\stackrel{铁屑}{→}$
+Br2$\stackrel{铁屑}{→}$ +HBr
+HBr下列说法错误的是( )
| A. | 制备溴苯的反应属于取代反应 | |
| B. | 白雾出现是因为HBr易挥发且极易溶于水 | |
| C. | 装置图中长直玻璃导管仅起导气作用 | |
| D. | 溴苯中溶有少量的溴,可用NaOH溶液洗涤除去 |
17.下列生产过程中,不涉及氧化还原反应的是( )
| A. | 氯碱工业 | B. | 制普通玻璃 | C. | 海水提溴 | D. | 工业制硝酸 |
7.某单官能团有机化合物只含碳、氢、氧三种元素,相对分子质量为58,完全燃烧时产生等物质的量的CO2和H2O,它的链状结构和环状结构的种类分别有(不考虑立体异构)( )
| A. | 1种、3种 | B. | 2种、2种 | C. | 2种、3种 | D. | 1种、2种 |
14.下列实验目的和操作对应不正确的是( )
| 实验目的 | 实验操作 | |
| A | 检验溶液中的Fe2+离子 | 向溶液中先加入KSCN溶液,再加入氯水 |
| B | 除去Na2SO4溶液中的Na2SO3 | 向混合液中加入适量稀盐酸 |
| C | 用豆浆做豆腐 | 向煮沸的豆浆中加入盐卤(含NaCl、MgCl2、CaCl2等)溶液 |
| D | 排除SO42-对Cl-检验的干扰 | 向混合液中加入过量的Ba(NO3)2溶液,过滤后再取滤液进行检验 |
| A. | A | B. | B | C. | C | D. | D |
11.水溶液中能大量共存的一组离子是( )
| A. | Mg2+、Ag+、NO3-、SO42- | B. | Fe3+、Cu2+、SO32-、ClO- | ||
| C. | Na+、K+、AlO2-、OH- | D. | Ca2+、H+、C6H5O-、I- |
10.某同学设计了由乙醇合成乙二醇的路线如下.下列说法正确的是( )
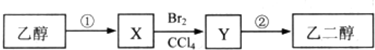

| A. | 等物质的量的乙醇、X完全燃烧,消耗氧气的量不相同 | |
| B. | 步骤②需要在氢氧化钠醇溶液中反应 | |
| C. | 步骤①的反应类型是水解反应 | |
| D. | X可以发生加成反应 |