题目内容
16.下列有关电解质溶液中微粒的关系正确的是( )| A. | 25℃时,pH=4的氯化铵溶液中:c(NH4+)>c(Cl-)>c(H+)>c(OH-) | |
| B. | 25℃时,pH=3的氯化铵溶液中:c(OH-)=1.0×10-3mol•L-1 | |
| C. | 将pH=5的醋酸溶液稀释后,恢复至原温度,pH和Kw均增大 | |
| D. | 向NH4HSO4溶液中加入等物质的量的NaOH形成的溶液中:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
分析 A.氯化铵溶液中,铵根离子部分水解,溶液显示酸性,则c(H+)>c(OH-),根据电荷守恒可得c(Cl-)>c(NH4+);
B.根据水的离子积计算溶液中氢氧根离子浓度;
C.温度不变,则水的离子积不变;
D.向NH4HSO4溶液中加入等物质的量的NaOH溶液,反应生成Na2SO4、H2O、(NH4)2SO4,然后根据各物质量的关系分析离子浓度大小.
解答 解:A.氯化铵溶液中,铵根离子部分水解,溶液显示酸性,则c(H+)>c(OH-),根据电荷守恒可得c(Cl-)>c(NH4+),则正确的离子浓度大小为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),故A错误;
B.25℃时,pH=3的氯化铵溶液中,氢离子浓度为c(H+)=1.0×10-3mol•L-1,由水的离子积可知,溶液中氢氧根离子浓度为c(OH-)=1.0×10-11mol•L-1,故B错误;
C.将pH=5的醋酸溶液稀释后,恢复至原温度,溶液中氢离子浓度减小,则溶液的pH增大,由于温度不变,则水的离子积Kw不变,故C错误;
D.向NH4HSO4溶液中加入等物质的量的NaOH溶液,反应生成Na2SO4、H2O、(NH4)2SO4,应用Na+、SO42-不水解,则c(Na+)=c(SO42-),NH4+水解显酸性,所以c(H+)>c(OH-),则离子浓度由大到小为:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-),故D正确;
故选D.
点评 本题考查了离子浓度大小比较、盐的水解原理及其应用,题目难度中等,明确电荷守恒、物料守恒及盐的水解原理为解答关键,试题侧重考查学生的分析、理解能力及灵活应用基础知识的能力.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
6.将Cl2通入适量KOH溶液,产物中可能有KC1、KClO、KC1O3,且$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$的值与温度高低有关.当n(KOH)=a mol时,下列有关说法不正确的是( )
| A. | 参加反应的氯气的物质的量等于$\frac{1}{2}$amol | |
| B. | 改变温度,产物中KC1O3的最大理论产量为1/7amol | |
| C. | 若某温度下,反应后$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$=11,则溶液中$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$=$\frac{1}{2}$ | |
| D. | 改变温度,反应中转移电子的物质的量ne的范围:$\frac{1}{2}$amol≤ne≤$\frac{5}{6}$amol |
7.某单官能团有机化合物只含碳、氢、氧三种元素,相对分子质量为58,完全燃烧时产生等物质的量的CO2和H2O,它的链状结构和环状结构的种类分别有(不考虑立体异构)( )
| A. | 1种、3种 | B. | 2种、2种 | C. | 2种、3种 | D. | 1种、2种 |
4.下列叙述I和Ⅱ均正确且具有因果关系的是( )
| 编号 | 叙述I | 叙述Ⅱ |
| A | Ksp(CaCO3)<Ksp(CaSO4) | 用Na2CO3溶液和盐酸除水垢CaSO4 |
| B | 金属钠有还原性 | 用金属钠检验无水乙醇中是否含有少量水 |
| C | 金属活动性铜比铁弱 | 镀铜铁制品表层划损后仍然受到保护 |
| D | Cl2具有漂白性 | 用氯气制盐酸 |
| A. | A | B. | B | C. | C | D. | D |
11.水溶液中能大量共存的一组离子是( )
| A. | Mg2+、Ag+、NO3-、SO42- | B. | Fe3+、Cu2+、SO32-、ClO- | ||
| C. | Na+、K+、AlO2-、OH- | D. | Ca2+、H+、C6H5O-、I- |
1.下列有关说法正确的是( )
| A. | 氢氧燃料电池的能量转换形式仅为化学能转化为电能 | |
| B. | 一定条件下,使用催化剂能加快反应速率但不能改变平衡转化率 | |
| C. | NH4Cl和HCl溶于水后滴加石蕊都变红色,说明它们均能电离出H+ | |
| D. | 在一密闭容器中发生2SO2+O2?2SO3反应,增大压强,平衡会正向移动,$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})•c({O}_{2})}$的值增大 |
6.下列化学用语表达正确的是( )
| A. | 醛基的结构简式:-COH | B. | 对硝基甲苯的结构简式: | ||
| C. | CH2F2的电子式: | D. | 乙烯的实验式:CH2 |
3.下列有关化学用语表示正确的是( )
| A. | 对硝基甲苯的结构简式: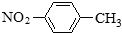 | B. | CH2F2的电子式: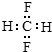 | ||
| C. | 乙醇的分子式:C2H5OH | D. | 乙炔的最简式:CH |