题目内容
19.已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp[Ag2CrO4(砖红色)]=9.0×10-12,下列说法不正确的是( )| A. | 温度相同时,溶解度大小顺序为S(Ag2CrO4)>S(AgCl)>S(AgBr) | |
| B. | 往含Cl-,Br-,CrO42-浓度均为0.01mol•L-1溶液中滴加0.01mol•L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为Br-、CrO42-、Cl- | |
| C. | 用滴定法测KNO3溶液中KCl的含量时,可选择用AgNO3溶液做标准液,Ag2CrO4溶液做指示剂 | |
| D. | 1.88gAgBr投入到100mol/LNaCl溶液中有AgCl |
分析 A.根据S(Ag2CrO4)=$\root{3}{{K}_{sp}(A{g}_{2}Cr{O}_{4})}$,S(AgCl)=$\sqrt{{K}_{sp}(AgCl)}$,S(AgBr)=$\sqrt{{K}_{sp}(AgBr)}$计算分析;
B.根据Ksp和阴离子的浓度求出溶液中银离子的浓度,c(Ag+)越小,则越先生成沉淀;
C.依据沉淀滴定原理:当氯离子完全反应时,溶液中会生成Ag2CrO4砖红色沉淀;
D.n(AgBr)=$\frac{1.88g}{188g/mol}$=0.01mol,形成AgBr的饱和溶液,c(Ag+)=$\sqrt{{K}_{sp}(AgBr)}$,根据Qc(AgCl)与Ksp(AgCl)相对大小分析.
解答 解:A.S(Ag2CrO4)=$\root{3}{{K}_{sp}(A{g}_{2}Cr{O}_{4})}$=$\root{3}{7.7×1{0}^{-13}}$,S(AgCl)=$\sqrt{{K}_{sp}(AgCl)}$=$\sqrt{1.56×1{0}^{-10}}$,S(AgBr)=$\sqrt{{K}_{sp}(AgBr)}$=$\sqrt{7.7×1{0}^{-13}}$,所以溶解度大小顺序为S(Ag2CrO4)>S(AgCl)>S(AgBr),故A正确;
B.析出沉淀时,AgCl溶液中c(Ag+)=$\frac{1.56×1{0}^{-10}}{0.01}$mol/L=1.56×10-8mol/L,AgBr溶液中c(Ag+)=$\frac{7.7×1{0}^{-13}}{0.01}$mol/L=7.7×10-11mol/L,Ag2CrO4溶液中c(Ag+)=$\sqrt{\frac{9.0×1{0}^{-12}}{0.01}}$mol/L=3×10-5,c(Ag+)越小,则越先生成沉淀,所以种阴离子产生沉淀的先后顺序为Br-、Cl-、CrO42-,故B错误;
C.由于在t℃时,AgCl的溶解度小于Ag2CrO4,故利用沉淀滴定法,用标准AgNO3溶液滴定KCl溶液的浓度时,可滴入几滴K2CrO4溶液做指示剂,当出现红色固体(Ag2CrO4),即达滴定终点,故C正确;
D.n(AgBr)=$\frac{1.88g}{188g/mol}$=0.01mol,形成AgBr的饱和溶液,c(Ag+)=$\sqrt{{K}_{sp}(AgBr)}$=$\sqrt{7.7×1{0}^{-13}}$mol/L,Qc(AgCl)=c(Cl-)×c(Ag+)=100×$\sqrt{7.7×1{0}^{-13}}$>Ksp(AgCl),则有AgCl沉淀生成,故D正确.
故选B.
点评 本题考查难溶电解质的溶解平衡问题,题目难度中等,注意根据溶解度判断生成沉淀的先后顺序,易错点为B,组成不相似的物质,不能直接根据溶度积判断.

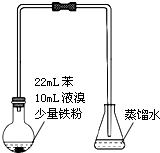 溴苯是不溶于水的液体,常温下不与酸、碱反应,可用如图装置制取(该反应放出热量).制取时观察到烧瓶中有大量红棕色蒸气,锥形瓶中导管口有白雾出现等现象.
溴苯是不溶于水的液体,常温下不与酸、碱反应,可用如图装置制取(该反应放出热量).制取时观察到烧瓶中有大量红棕色蒸气,锥形瓶中导管口有白雾出现等现象.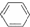 +Br2$\stackrel{铁屑}{→}$
+Br2$\stackrel{铁屑}{→}$ +HBr
+HBr下列说法错误的是( )
| A. | 制备溴苯的反应属于取代反应 | |
| B. | 白雾出现是因为HBr易挥发且极易溶于水 | |
| C. | 装置图中长直玻璃导管仅起导气作用 | |
| D. | 溴苯中溶有少量的溴,可用NaOH溶液洗涤除去 |
| A. | 1种、3种 | B. | 2种、2种 | C. | 2种、3种 | D. | 1种、2种 |
| 实验目的 | 实验操作 | |
| A | 检验溶液中的Fe2+离子 | 向溶液中先加入KSCN溶液,再加入氯水 |
| B | 除去Na2SO4溶液中的Na2SO3 | 向混合液中加入适量稀盐酸 |
| C | 用豆浆做豆腐 | 向煮沸的豆浆中加入盐卤(含NaCl、MgCl2、CaCl2等)溶液 |
| D | 排除SO42-对Cl-检验的干扰 | 向混合液中加入过量的Ba(NO3)2溶液,过滤后再取滤液进行检验 |
| A. | A | B. | B | C. | C | D. | D |
| 编号 | 叙述I | 叙述Ⅱ |
| A | Ksp(CaCO3)<Ksp(CaSO4) | 用Na2CO3溶液和盐酸除水垢CaSO4 |
| B | 金属钠有还原性 | 用金属钠检验无水乙醇中是否含有少量水 |
| C | 金属活动性铜比铁弱 | 镀铜铁制品表层划损后仍然受到保护 |
| D | Cl2具有漂白性 | 用氯气制盐酸 |
| A. | A | B. | B | C. | C | D. | D |
| A. | Mg2+、Ag+、NO3-、SO42- | B. | Fe3+、Cu2+、SO32-、ClO- | ||
| C. | Na+、K+、AlO2-、OH- | D. | Ca2+、H+、C6H5O-、I- |
| A. | 醛基的结构简式:-COH | B. | 对硝基甲苯的结构简式: | ||
| C. | CH2F2的电子式: | D. | 乙烯的实验式:CH2 |
| A. | 加碘食盐能使淀粉溶液变蓝 | |
| B. | 向水中通入O2,用以杀菌消毒 | |
| C. | 二氧化硅可用于制造半导体材料 | |
| D. | 向高硫煤中加入生石灰,可减少燃煤对大气的污染 |