题目内容
4.通常条件下,下列材质的水龙头连接在铁质自来水管上,铁管的腐蚀最快的是( )| A. | 铁水龙头 | B. | 铜水龙头 | C. | 塑料水龙头 | D. | 铝水龙头 |
分析 铁管上所连接的水龙头的材质,决定了铁管和水龙头能否形成原电池,当能形成原电池时,如果铁管做负极,则腐蚀速率会加快,如果铁管做正极,则腐蚀速率会变慢,据此分析.
解答 解:A、铁管与铁质水龙头相连,由于材质相同,故不能形成原电池,则不能加快腐蚀速率;
B、铁制自来水管与铜水龙头相连接,这样Cu、Fe以及自来水形成原电池,Fe的活动性强于Cu,金属铁作负极,故使Fe锈蚀更快;
C、铁管与塑料水龙头相连时,由于塑料不导电,故不能形成原电池,不能加快反应速率;
D、铁管与铝制的水龙头相连,铝比铁活泼,铁管做正极被保护,腐蚀速率变慢.
综合分析,腐蚀速率最快的是B.
故选B.
点评 本题考查了金属锈蚀的条件,完成此题,可以依据已有的知识进行.

练习册系列答案
 互动英语系列答案
互动英语系列答案
相关题目
12.电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.下列说法正确的是( )
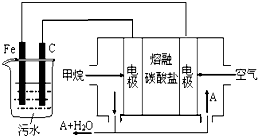

| A. | Fe为阳极,其电极反应为:Fe-3e-+3OH-=Fe(OH)3↓ | |
| B. | 通入甲烷的电极为负极,其电极反应为:CH4-8e-+10OH-=CO32-+7H2O | |
| C. | 为了使该燃料电池长时间稳定运行,电池工作时必须 有部分A物质参加循环.A物质是CO2 | |
| D. | 实验过程中,若在阴极产生了4.48 L气体,则电路中通过的电子个数为0.4NA |
19.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | T℃时,pH=6的纯水中,含有的OH-数目为1×10-6NA | |
| B. | 标准状况下,22.4LCCl4中含有的共用电子对数目为4.0NA | |
| C. | 50g98%的浓硫酸中,所含的氧原子数目为2NA | |
| D. | 1molNa2O2与足量CO2充分反应转移的电子数目为NA |
9.下列关于有机物的说法中,错误的是( )
| A. | 乙烯常温下是气体,聚乙烯常温下是固体 | |
| B. | 苯可做有机溶剂 | |
| C. | 乙醇和乙烯都能发生加成反应 | |
| D. | 油脂可用来制造肥皂 |
16.下列各组离子在水溶液中能大量共存的是( )
| A. | Cu2+、H+、SO42-、Cl- | B. | Na+、Ba2+、NO3-、CO32- | ||
| C. | Al3+、H+、CO32-、Cl- | D. | Ba2+、OH-、Fe2+、NO3- |
13.在一定条件下,一定量的A和B气体发生如下可逆反应:2A(g)+3B(g)?3C(g),只有反应到达平衡时才具有的性质是( )
| A. | 各物质的浓度之比为2:3:3 | |
| B. | ν(A)、ν(B)、ν(C) 之比为2:3:3 | |
| C. | A、B、C三种物质的浓度不随时间变化而变化 | |
| D. | 混合物各物质的量浓度相等 |

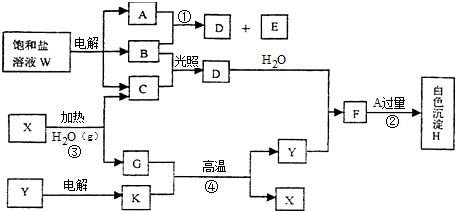
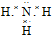 ,B的晶体类型是分子晶体.
,B的晶体类型是分子晶体.