题目内容
1.新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液.某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示.回答下列问题:
(1)甲烷燃料电池正极、负极的电极反应分别为2O2+4H2O+8e-=8OH-、CH4+10OH--8e-=CO32-+7H2O
(2)闭合K开关后,a电极电极名称是阳极,电极方程式为2Cl--2e-=Cl2↑
(3)若标准状况下,每个燃料电池中通入1.12L甲烷气体完全反应,则电解池中产生氯气体积为4.48L.
分析 (1)甲烷碱性燃料电池中正极氧气得电子被还原,负极甲烷失电子被氧化;
(2)a连接电源的正极,应为阳极,氯离子放电生成氯气;
(3)根据关系式1 mol CH4~8 mol e-~4 mol Cl2计算.
解答 解:(1)在碱性溶液中,甲烷燃料电池的总反应式为:CH4+2O2+2OH-=CO32-+3H2O,正极是:2O2+4H2O+8e-═8OH-,负极是:CH4-8e-+10OH-═CO32-+7H2O.
故答案为:2O2+4H2O+8e-=8OH-;CH4+10OH--8e-=CO32-+7H2O;
(2)a电极与通入氧气的电极相连,作阳极,是Cl-放电,生成Cl2;电极反应式为2Cl--2e-=Cl2↑,故答案为:阳极;2Cl--2e-=Cl2↑;
(3)根据得失电子守恒,可得:1 mol CH4~8 mol e-~4 mol Cl2,故若每个电池甲烷通入量为1.12 L(标准状况),生成4×1.12L=4.48L Cl2;
故答案为:4.48.
点评 本题考查了电解池和原电池的主体内容,涉及电极判断与电极反应式书写等问题,做题时注意从氧化还原的角度判断原电池的正负极以及电极方程式的书写,本题中难点和易错点为电极方程式的书写.

练习册系列答案
 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
11.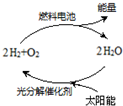 能源是当今社会发展的三大支柱之一.有专家预测氢能源将是未来最理想的新能源,而最理想的氢的循环模式如图,此循环可以节约原料,缓解能源危机.在此构想的物质循环中太阳能最终转化为( )
能源是当今社会发展的三大支柱之一.有专家预测氢能源将是未来最理想的新能源,而最理想的氢的循环模式如图,此循环可以节约原料,缓解能源危机.在此构想的物质循环中太阳能最终转化为( )
 能源是当今社会发展的三大支柱之一.有专家预测氢能源将是未来最理想的新能源,而最理想的氢的循环模式如图,此循环可以节约原料,缓解能源危机.在此构想的物质循环中太阳能最终转化为( )
能源是当今社会发展的三大支柱之一.有专家预测氢能源将是未来最理想的新能源,而最理想的氢的循环模式如图,此循环可以节约原料,缓解能源危机.在此构想的物质循环中太阳能最终转化为( )| A. | 化学能 | B. | 热能 | C. | 生物能 | D. | 电能 |
9.如表所示,为提纯下列物质(括号内为杂质),所用的除杂试剂和分离方法都正确的是( )
| 序号 | 不纯物 | 除杂试剂 | 分离方法 |
| A | CH4(C2H4) | 酸性KMn04溶液 | 洗气 |
| B | NH4Cl溶液(FeCl3) | NaOH溶液 | 过滤 |
| C | 福尔马林(甲酸) | Na2CO3溶液 | 蒸馏 |
| D | 苯(苯酚) | 溴 水 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
16.下列各图中,表示吸热反应的是( )
| A. | 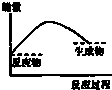 | B. |  | C. | 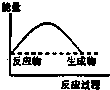 | D. | 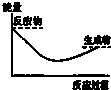 |
6. 如图为直流电源电解稀Na2SO4水溶液的装置.通电后在石墨电极a和b附近分别滴加几滴石蕊溶液.下列实验现象描述正确的( )
如图为直流电源电解稀Na2SO4水溶液的装置.通电后在石墨电极a和b附近分别滴加几滴石蕊溶液.下列实验现象描述正确的( )
 如图为直流电源电解稀Na2SO4水溶液的装置.通电后在石墨电极a和b附近分别滴加几滴石蕊溶液.下列实验现象描述正确的( )
如图为直流电源电解稀Na2SO4水溶液的装置.通电后在石墨电极a和b附近分别滴加几滴石蕊溶液.下列实验现象描述正确的( )| A. | 逸出气体的体积,a电极的小于b电极的 | |
| B. | 一电极逸出无味气体,另一电极逸出刺激性气体 | |
| C. | a电极附近呈红色,b电极附近呈蓝色 | |
| D. | a电极附近呈蓝色,b电极附近呈红色 |
13.CH3CH2CH2CH3(正丁烷)和CH(CH2) 3(异丁烷)互为 ( )
| A. | 同分异构体 | B. | 同位素 | C. | 同素异形体 | D. | 同系物 |
4.通常条件下,下列材质的水龙头连接在铁质自来水管上,铁管的腐蚀最快的是( )
| A. | 铁水龙头 | B. | 铜水龙头 | C. | 塑料水龙头 | D. | 铝水龙头 |
