题目内容
2.下列各组酸中,酸性依次增强的是( )| A. | H2CO3 H2SiO3 H3PO4 | B. | HNO3 H3PO4 H2SO4 | ||
| C. | HI HCl H2S | D. | HClO HClO3 HClO4 |
分析 A.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
C.同一主族元素,元素的非金属性越强,其氢化物在水溶液中越难电离,则其氢化物水溶液酸性越弱;
D.同一种元素含氧酸中,非羟基O原子个数越多其酸性越强.
解答 解:A.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性P>C>Si,所以酸性:H2SiO3<H2CO3<H3PO4,故A错误;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性N>P,所以酸性HNO3>H3PO4,故B错误;
C.同一主族元素元素的非金属性越强,其氢化物在水溶液中越难电离,则其氢化物水溶液酸性越弱,氢硫酸是弱酸,HCl、HI是强电解质,相同浓度时酸性由弱到强顺序是:H2S<HCl<HI,故C错误;
D.同一种元素含氧酸中,非羟基O原子个数越多其酸性越强,HClO、HClO3、HClO4中非羟基O原子个数分别是0、2、3,所以酸性由弱到强顺序是HClO、HClO3、HClO4,故D正确;
故选D.
点评 本题考查酸性强弱判断,明确酸性强弱比较方法是解本题关键,酸性强弱与其电离程度有关,注意D中酸性强弱比较方法,为易错点.

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
12.某澄清透明溶液,当溶液呈强酸性时,有气体放出,当溶液呈强碱性时,有白色沉淀生成.则该溶液中可能大量共存的离子组是( )
| A. | K+、Ba2+、NO3-、S2- | B. | NH4+、Fe3+、Cl-、ClO- | ||
| C. | Na+、Al3+、S2-、CH3COO- | D. | K+、Ca2+、Br-、HCO3- |
10.下列化合物沸点比较错误的是( )
| A. | 丙三醇>丙二醇>丙醇 | B. | 正戊烷>异戊烷>新戊烷 | ||
| C. | 丙醇>乙醇>甲醇>丁烷 | D. | 对二甲苯>邻二甲苯>间二甲苯 |
14.用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加快的是( )
| A. | 加热 | B. | 不用铁片,改用铁粉 | ||
| C. | 适当提高硫酸浓度 | D. | 不用稀硫酸,改用98%浓硫酸 |
11.某有机物的结构简式为CH2=C(CH3)-CHO,它不能发生的反应的是( )
| A. | 加成反应 | B. | 聚合反应 | C. | 消去反应 | D. | 银镜反应 |
12.燃烧热是指通常状况下1mol纯物质完全燃烧生成稳定的化合物所放出的热量,下列说法正确的是( )
| A. | 通常状况下,1g氢气燃烧生成液态水时放出142.9kJ的热量,则表示氢气燃烧热的热化学方程式为2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol | |
| B. | 已知H2(g)+F2(g)═2HF(g),△H=-270kJ/mol,则1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量小于270kJ | |
| C. | 500℃、30MPa下,将0.5mol N2和1.5mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为N2(g)+3H2(g)$?_{催化剂}^{高温、高压}$2NH3(g),△H=-38.6kJ/mol | |
| D. | 已知:①C(s石墨)+O2(g)═CO2(g),△H=-393.5kJ/mol,②C(s,金刚石)+O2(g)═CO2(g),△H=-395.0kJ/mol,则C(s,金刚石)═C(s,石墨),△H=-1.5kJ/mol |
 有机物A是一种含溴的酯,分子式为C6H9O2Br,已知有如下的转化关系:
有机物A是一种含溴的酯,分子式为C6H9O2Br,已知有如下的转化关系: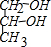 或HOCH2CH2CH2OH.
或HOCH2CH2CH2OH. (R表示烃基)的有2种.
(R表示烃基)的有2种.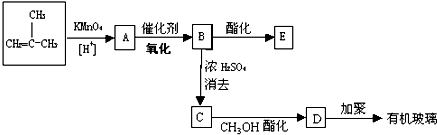
 C
C E
E
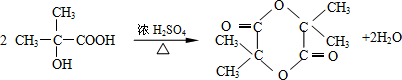 ;
;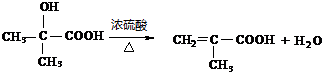 ;
;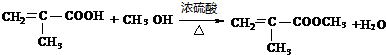 .
.