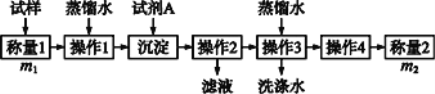
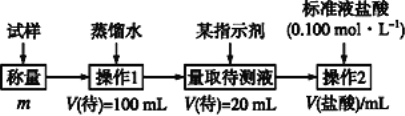
题目内容
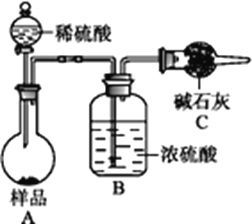
【题目】某校化学实验小组设计下图装置制备氯气,图中涉及气体发生、除杂、干燥、收集及尾气处理装置。
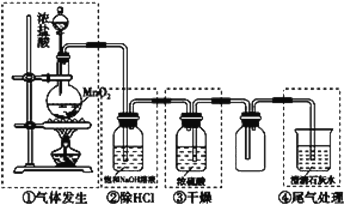
(1)上述装置中,错误的是____________(选填字母)。
A.①②④ B.②③④ C.①③④ D.①②③
(2)写出装置①中发生反应的化学方程式是___________________,将收集到的纯净氯气通入到碘化钾溶液中,再向其中加入四氯化碳振荡后静置,最终的实验现象是_____,发生反应的化学方程式是___________________。
(3)生产氯气的工业称为“氯碱工业”,写出化学方程式______________。
(4)久置氯水的漂白作用会失效,写出发生该反应的化学方程式__________。
(5)工业上用氯气生产漂白粉的化学反应方程式为_____________________。
【答案】B MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O 溶液分层,上层为无色的水层,下层为紫红色的油层 Cl2+2KI=2KCl+I2 2NaCl+2H2O
MnCl2+Cl2↑+2H2O 溶液分层,上层为无色的水层,下层为紫红色的油层 Cl2+2KI=2KCl+I2 2NaCl+2H2O ![]() Cl2↑+ H2↑+2NaOH 2HClO
Cl2↑+ H2↑+2NaOH 2HClO ![]() 2HCl+O2↑ 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
2HCl+O2↑ 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
【解析】
①是实验室制备氯气的装置,用浓盐酸和二氧化锰反应在加热条件下反应,制备得到的氯气中含氯化氢、水蒸气,装置②可以除去氯化氢气体,装置③是干燥氯气的装置,然后利用排空气法收集氯气,最后剩余氯气用碱溶液吸收,防止污染空气,据此分析解答。
(1)题中装置②中氢氧化钠也能除去氯气,应用饱和食盐水除去氯化氢,装置③应该长进短出,装置④中澄清石灰水浓度太低,不能很好的除去氯气,应用氢氧化钠溶液吸收氯气,有错误的装置是②③④,故答案为:B;
(2)装置①中浓盐酸和二氧化锰在加热条件下反应生成氯气,反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;将收集到的纯净氯气通入到碘化钾溶液中,发生的反应为Cl2+2KI=2KCl+I2,再向其中加入四氯化碳振荡后静置,碘易溶于四氯化碳,发生萃取,四氯化碳不溶于水,且密度比水大,最终的实验现象为溶液分层,上层为无色的水层,下层为紫红色的油层,故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;将收集到的纯净氯气通入到碘化钾溶液中,发生的反应为Cl2+2KI=2KCl+I2,再向其中加入四氯化碳振荡后静置,碘易溶于四氯化碳,发生萃取,四氯化碳不溶于水,且密度比水大,最终的实验现象为溶液分层,上层为无色的水层,下层为紫红色的油层,故答案为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;溶液分层,上层为无色的水层,下层为紫红色的油层;Cl2+2KI=2KCl+I2;
MnCl2+Cl2↑+2H2O;溶液分层,上层为无色的水层,下层为紫红色的油层;Cl2+2KI=2KCl+I2;
(3)氯碱工业的原理是电解饱和的食盐水,反应的化学方程式为2NaCl+2H2O ![]() Cl2↑+ H2↑+2NaOH,故答案为:2NaCl+2H2O
Cl2↑+ H2↑+2NaOH,故答案为:2NaCl+2H2O ![]() Cl2↑+ H2↑+2NaOH;
Cl2↑+ H2↑+2NaOH;
(4)氯水含有盐酸和次氯酸,次氯酸容易分解,2HClO ![]() 2HCl+O2↑,因此久置氯水的漂白作用会失效,故答案为:2HClO
2HCl+O2↑,因此久置氯水的漂白作用会失效,故答案为:2HClO ![]() 2HCl+O2↑;
2HCl+O2↑;
(5)工业上用氯气与石灰乳反应生产漂白粉,反应的化学反应方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。