题目内容
12.某恒温密闭容器中,可逆反应A(s)?B+C(g)△H=+QkJ/mol(Q>O) 达到平衡.缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等.以下分析正确的是( )| A. | 保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动 | |
| B. | 平衡时,单位时间内c(A)消耗:c(C)消耗=1:1 | |
| C. | 产物B的状态只能为固态或液态 | |
| D. | 若开始时向容器中加入1mol B和1mol C,达到平衡时放出热量QkJ |
分析 A、保持体积不变,若B为气态,则向平衡体系中加入B,平衡逆向移动,B为固体,则平衡不动;
B、平衡时,各物质的量不再改变,正反应速率和逆反应速率相等,因此单位时间内n(A)消耗=n(C)消耗;
C、若B为气体,且原平衡时B与C的浓度相等时,因容器保持恒温,缩小容器体积,达到新平衡时平衡常数不变,则气体C的浓度也一定不变;
D、因反应为可逆反应,故加入1molB和1molC至反应达到平衡时不能完全消耗,放出热量小于Q.
解答 解:A、保持体积不变,B可以是气体或是非气体,则向平衡体系中加入B,平衡可能不移动,也可能逆向进行,故A正确;
B、平衡时,各物质的量不再改变,正反应速率和逆反应速率相等,因此单位时间内n(A)消耗=n(C)消耗,但A为固体,没有浓度变化,故B错误;
C、若B是气体,平衡常数K=c(B)•c(C),若B是非气体,平衡常数K=c(C),由于C(g)的浓度不变,因此B可以是非气体也可以是气态,故C错误;
D、因反应为可逆反应,故加入1molB和1molC至反应达到平衡时转化率一定小于100%,因此放出热量小于Q,故D错误;
故选A.
点评 本题考查化学平衡影响因素的分析判断,化学判断移动原理的理解设计解题关键,题目难度中等.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
20.下列实验方法不科学的是( )
| A. | 除去水中含有少量的KNO3:通过蒸馏后收集水 | |
| B. | 检验溶液中的铵根离子:与碱共热,并用湿润的红色石蕊试纸检验产生的气体 | |
| C. | 除去KI固体中的少量碘单质(I2):置于坩埚中加热 | |
| D. | SO42-的检验:溶液先用稀HNO3酸化,然后滴加BaCl2溶液,看是否有沉淀生成 |
7.根据下列各图曲线表征的信息,得出的结论错误的是( )
| A. |  表示H2与O2发生反应过程中的能量变化,H2的燃烧热为285.8 kJ/mol | |
| B. |  由图得出若除去CuSO4溶液中的Fe3+,可采用向溶液中加入适量CuO,调节溶液的pH至4左右 | |
| C. |  表示用水稀释pH相同的盐酸和醋酸时溶液的pH变化曲线,其中Ⅰ表示醋酸,Ⅱ表示盐酸,且溶液导电性:c>b>a | |
| D. | 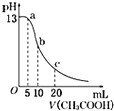 表示常温下向体积为10 mL 0.1 mol/LNaOH溶液中逐滴加入0.1 mol/L CH3COOH溶液后溶液的pH变化曲线,则b点处有:c(CH3COOH)+c(H+)=c(OH-) 表示常温下向体积为10 mL 0.1 mol/LNaOH溶液中逐滴加入0.1 mol/L CH3COOH溶液后溶液的pH变化曲线,则b点处有:c(CH3COOH)+c(H+)=c(OH-) |
17.二氧化硒( SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HN03或浓H2S04反应生成SeO2以回收Se.在回收过程中涉及如下化学反应:①SeO2+4KI+4HN03═Se+2I2+4KN03+2H2O;②Se+2H2S04(浓)═2SO2+Se02+2H20;③Se+4HN03(浓)═Se0+4N02+2H20.下列有关叙述正确的是( )
| A. | SeO2、H2S04(浓)、I2的氧化性由强到弱的顺序是H2S04(浓)>SeO2>I2 | |
| B. | 反应①中Se是氧化产物,I2是还原产物 | |
| C. | 反应①中生成0.6 mol I2,转移的电子数目为2.4NA | |
| D. | 反应②、③中等量的Se消耗浓H2S04和浓HN03的物质的量之比为2:1 |
1.在无色的水溶液中能大量共存的一组离子是( )
| A. | Al3+、Na+、Cl-、H+ | B. | H+、Fe2+、ClO-、Cl- | ||
| C. | Na+、Al3+、Cl-、OH- | D. | K+、Ba2+、Cu2+、Cl- |
2.某温度时,在恒容密闭容器中,X、Y、Z三种气体浓度的变化如图I所示,若其它条件不变,当温度分别为T1和T2时,Y的体积分数与时间关系如图II所示.则下列结论正确的是( )
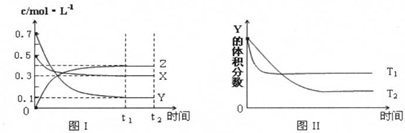

| A. | 该反应的热化学方程式为:3X(g)+Y(g)?4Z(g);△H>0 | |
| B. | 若其它条件不变,平衡后又加入一定量X,正速率增大、逆速率减小,X的转化率减小 | |
| C. | 达到平衡后,若其他条件不变,升高温度,平衡向逆反应方向移动 | |
| D. | 达到平衡后,若其他条件不变,减小容器体积,平衡不移动 |