题目内容
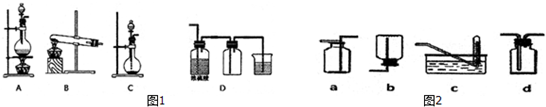
3.实验室常用的几种气体发生装置如图1A、B、C、D所示:(1)实验室可以用B或C.装置制取氨气,如果用C装置,通常使用的药品是浓氨水和氧化钙或氢氧化钠固体或碱石灰.检查C装置气密性是否良好的操作方法是将导气管通入水槽中,用手捂住圆底烧瓶底部,若导气管口处有气泡冒出,松开手后在导气管中形成一段水柱,证明气密性完好..
若用B装置制取氨气,用化学方程式表示制取氨气的反应原理Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(2)若用KMnO4与浓盐酸反应制取氯气,应选用的气体发生装置是C,用离子方程式表示制取氯气的反应原理2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O.
(3)若用A装置与D装置相连制取收集X气体,则X可能是下列气体中的③.
①CO2 ②NO ③Cl2 ④H2.其中在D装置连接小烧杯目的是吸收尾气防止产生污染,发生反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O.
(4)如图2是某同学设计收集氨气的几种装置,其中可行的是d.
分析 (1)C装置是液体和固体不需要加热进行的气体制备反应装置,据此选择合适的试剂;依据装置气密性检查的常规方法回答;B装置制取氨气,反应物为固体与液体加热制备气体;
(2)KMnO4与浓盐酸反应制取氯气,选择装置我固体与液体不加热;
(3)若用A装置与D装置相连制取收集X气体,制取气体的特点为:反应物为固体与液体加热,密度大于空气密度,且气体可利用浓硫酸干燥,需要尾气处理;氯气有毒,直接排放能够引起空气污染,应进行尾气处理,氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水;
(4)依据氨气密度小于空气密度,极易溶于水选择合适的收集装置.
解答 解:(1)C装置适用于固体和液体不加热制气体,制取氨气应选择浓氨水和氧化钙或碱石灰或氢氧化钠固体;
检查装置气密性的方法是利用压强变化和液面变化来设计检验,将导气管通入水槽中,用手捂住圆底烧瓶底部,若导气管口处有气泡冒出,松开手后在导气管中形成一段水柱,证明气密性完好;
采用B装置制备氨气时应选择用氢氧化钙和氯化铵固体加热反应,反应方程式:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
故答案为:浓氨水和氧化钙或氢氧化钠固体或碱石灰;将导气管通入水槽中,用手捂住圆底烧瓶底部,若导气管口处有气泡冒出,松开手后在导气管中形成一段水柱,证明气密性完好;Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(2)KMnO4与浓盐酸反应制取氯气,选择装置我固体与液体不加热,所以应选择装置C;
高锰酸钾与浓盐酸反应生成氯化钾、氯化锰、氯气和水,离子方程式:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O,
故答案为:C;2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
(3)若用A装置与D装置相连制取收集X气体,制取气体的特点为:反应物为固体与液体加热,密度大于空气密度,且气体可利用浓硫酸干燥,需要尾气处理;
①.制取CO2时不需要加热也不不必处理尾气,故A错误;
②.NO不能用排空气法收集,故B错误;
③.二氧化锰与浓盐酸加热生成氯气,氯气密度大于空气密度,能够用浓硫酸干燥,氯气可以用氢氧化钠溶液吸收尾气,故C正确;
④.氢气密度小于空气 密度,故D错误;
氯气有毒,直接排放能够引起空气污染,应进行尾气处理,氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,离子方程式:Cl2+2OH-=Cl-+ClO-+H2O;
故选:③;Cl2+2OH-=Cl-+ClO-+H2O;
(4)氨气密度小于空气密度,极易溶于水,应选择向下排气法收集,不能用排水法收集,收集不能用密封装置,
所以只有d符合题意;
故选:d.
点评 本题考查了气体的实验室制备和装置的应用,明确气体制备原理是解题关键,侧重考查学生对实验知识掌握的熟练程度,题目难度中等.

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案| A. | 往石灰乳中通入过量的CO2:OH-+CO2═HCO3- | |
| B. | amol FeBr2溶液中通入amol Cl2:2Fe2++2Br-+2Cl2═Br2+2Fe3++4C1- | |
| C. | 碳酸氢钙溶液加到醋酸中:Ca(HCO3)2+2CH3COOH═Ca2++2CH3COO-+2CO2↑+2H2O | |
| D. | 向50mL 1mol•L-1明矾溶液中滴入数滴0.1mol•L-1Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
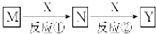
| A. | M:Na X:O2 | B. | M:HNO3 X:Fe | C. | M:NH3 X:O2 | D. | M:Al X:NaOH |
| A. | 保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动 | |
| B. | 平衡时,单位时间内c(A)消耗:c(C)消耗=1:1 | |
| C. | 产物B的状态只能为固态或液态 | |
| D. | 若开始时向容器中加入1mol B和1mol C,达到平衡时放出热量QkJ |
| A. | Ba(NO3)2溶液 | B. | 盐酸 | C. | 硫酸钠 | D. | 酚酞 |