题目内容
5. 环己酮是重要化工原料,可用于制造尼龙、己二酸产品.可以尝试用次氯酸钠氧化环己醇制备环己酮:
环己酮是重要化工原料,可用于制造尼龙、己二酸产品.可以尝试用次氯酸钠氧化环己醇制备环己酮:
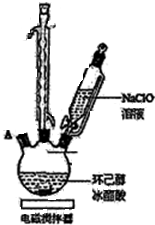
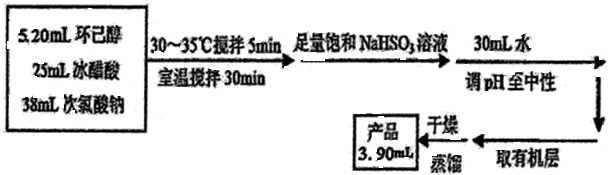
有关物质信息、实验流程及实验装置如图:
| 密度g/cm3 | 沸点℃ | 熔点℃ | 水溶性 | |
| 乙酸 | 1.05 | 117.9 | 16.6 | 易溶 |
| 环己醇 | 0.96 | 160.8 | 25.9 | 微溶 |
| 环己酮 | 0.95 | 155 | -4.5 | 能溶 |
(1)实验中盛装NaClO溶液的仪器比普通分液漏斗多了一个侧管,此设计的目的为平衡气压,使液体可以顺利流下.
(2)次氯酸钠氧化环己醇的反应放出大量的热,为了将体系温度维持在30~35℃,除了用冰水水浴冷却外,采取的措施还可能有缓慢滴加NaClO溶液或电磁搅拌器搅拌等,并应在三颈瓶的A端口处应补加温度计(仪器名称).
(3)实验过程中NaClO溶液氧化环己醇的化学方程式为
 .
.(4)为将溶液的pH调至中性,可以加入的试剂是碳酸钠或氢氧化钠等.
(5)在实验过程中,获得产品的蒸馏操作中不可使用水冷凝管,而应使用空气冷凝管(
 ),其最可能的原因是A(填写选项编号)
),其最可能的原因是A(填写选项编号)A、防止因温差过大,水冷凝管易炸裂
B、空气冷凝管结构简单,易于安装
C、空气冷凝管冷凝效果更佳
(6)计算本实验过程中环己酮的产率75.7%.
分析 (1)平衡气压,可以使液体顺利流下;
(2)降低反应速率,搅拌加速热量传递,通过温度计控制反应体系的温度,
(3)NaClO溶液将环己醇氧化为环己酮,同时生成氯化钠与水;
(4)加入饱和亚硫酸氢钠溶液,除去溶液中过量的次氯酸钠,发生反应:ClO-+HSO3-═Cl-+H++SO42-,溶液呈酸性,可加入无水碳酸钠或氢氧化钠等碱性物质,调节溶液pH=7;
(5)使用水冷凝管,温差过大,会导致水冷凝管炸裂;
(6)根据环己醇的量计算计算环己酮的理论产量,产率=(实际产量÷理论产量)×100%.
解答 解:(1)实验中盛装NaClO溶液的仪器比普通分液漏斗多了一个侧管,此设计的目的为:平衡气压,使液体可以顺利流下,
故答案为:平衡气压,使液体可以顺利流下;
(2)次氯酸钠氧化环己醇的反应放出大量的热,为了将体系温度维持在30~35℃,除了用冰水水浴冷却外,采取的措施还可能有:缓慢滴加NaClO溶液,降低反应速率,用电磁搅拌器搅拌,加速热量传递,并应在三颈瓶的A端口处应补加温度计,控制反应体系的温度,
故答案为:缓慢滴加NaClO溶液或电磁搅拌器搅拌等;温度计;
(3)NaClO溶液将环己醇氧化为环己酮,同时生成氯化钠与水,反应方程式为: ,
,
故答案为: ;
;
(4)加入饱和亚硫酸氢钠溶液,除去溶液中过量的次氯酸钠,发生反应:ClO-+HSO3-═Cl-+H++SO42-,溶液呈酸性,可加入无水碳酸钠或氢氧化钠等碱性物质,调节溶液pH=7,
故答案为:碳酸钠或氢氧化钠等;
(5)使用水冷凝管,温差过大,会导致水冷凝管炸裂,故选:A;
(6)环己醇的质量为5.2mL×0.96g/mL=4.992g,故环己酮的理论产量为4.992g×$\frac{98}{100}$,则其产率为[(3.9mL×0.95g/mL)÷4.992g×$\frac{98}{100}$)×100%=75.7%,
故答案为:75.7%.
点评 本题考查有机物制备实验,涉及对仪器、控制条件、操作等分析评价以及产率计算等,是对学生综合能力的考查,难度中等.

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 2009年2月21日,法国佳士得拍卖行“伊去•圣洛朗与皮埃尔•贝尔热珍藏”专物拍卖会拍卖品预展在法国巴黎大皇宫拉开帷幕.25日,中国圆明园流失文物鼠首和兔首铜像被拍卖.普通铜器的时间稍久容易出现铜绿,其主要成分是Cu2(OH)2CO3.这两件铜铸的国宝仍然熠熠生辉不生锈,下列对其主要原因的分析,最可能的是( )
2009年2月21日,法国佳士得拍卖行“伊去•圣洛朗与皮埃尔•贝尔热珍藏”专物拍卖会拍卖品预展在法国巴黎大皇宫拉开帷幕.25日,中国圆明园流失文物鼠首和兔首铜像被拍卖.普通铜器的时间稍久容易出现铜绿,其主要成分是Cu2(OH)2CO3.这两件铜铸的国宝仍然熠熠生辉不生锈,下列对其主要原因的分析,最可能的是( )| A. | 它们的表面都镀上了一层耐腐蚀的黄金 | |
| B. | 环境污染日趋严重,它们表面的铜绿被酸雨溶液溶解洗去 | |
| C. | 铜的金属活动性比氢小,因此不易被氧化 | |
| D. | 它们是含一定比例金、银、锡、锌的铜合金 |
| A. | 淀粉 | B. | 酶 | C. | 油脂 | D. | 天然橡胶 |
 已知某气态团簇分子由X、Y、Z三种元素组成,其分子晶胞如图所示,则下面表示该化合物的分子式正确的是( )
已知某气态团簇分子由X、Y、Z三种元素组成,其分子晶胞如图所示,则下面表示该化合物的分子式正确的是( )| A. | ZXY3 | B. | ZX2Y6 | C. | ZX4Y8 | D. | ZX8Y12 |
2A-+B2═2B-+A2 2C-+A2═2A-+C22B-+D2═2D-+B2
判断下列说法正确的是( )
| A. | 氧化性:A2>B2>C2>D2 | B. | 还原性:A->B->C->D- | ||
| C. | 2A-+D2═2D-+A2反应可以进行 | D. | 2C-+B2═2B-+C2反应不能进行 |