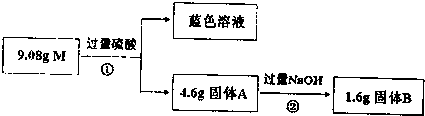
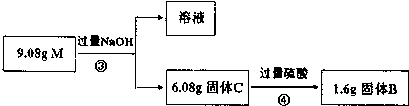
题目内容
18.部分短周期元素的原子结构及相关性质如表所示:| 元素编号 | 元素性质或原子结构 |
| T | 最高正价与最低负价的代数和为4 |
| X | 最外层电子数是次电子数次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物的水溶液呈碱性 |
| Z | 最高正价是+7价 |
(1)T在元素周期表中的位置为第三周期第ⅥA族.
(2)X的一种同位素可用于测定文物年代,该同位素为614C(用原子符号表示).
(3)Z单质的电子式为
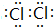 ;Y的氢化物的水溶液显碱性的原因为NH3+H2O?NH3•H2O?NH4++OH-(用离子方程式表示).
;Y的氢化物的水溶液显碱性的原因为NH3+H2O?NH3•H2O?NH4++OH-(用离子方程式表示).(4)Z与T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是d(填选项字母)
a.常温下,Z单质为气体,T单质为固体
b.Z的氢化物的水溶液的酸性比T强
c.Z的最高正价比Y高
d.最高价氧化物对应水化物的酸性Z比T强
(5)Z的氢化物与Y的氢化物发生化合反应,产物中含有的化学键类型为离子键、共价键.
分析 短周期元素中,T元素的最高正价与最低负价的代数和为4,则T为S元素;X元素原子最外层电子数是次电子数次外层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故X为C元素;常温下Y元素单质为双原子分子,其氢化物的水溶液呈碱性,则Y为N元素;Z元素的最高正价是+7价,则Z为Cl,据此解答.
解答 解:短周期元素中,T元素的最高正价与最低负价的代数和为4,则T为S元素;X元素原子最外层电子数是次电子数次外层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故X为C元素;常温下Y元素单质为双原子分子,其氢化物的水溶液呈碱性,则Y为N元素;Z元素的最高正价是+7价,则Z为Cl.
(1)T为S元素,在元素周期表中的位置为:第三周期第ⅥA族,故答案为:第三周期第ⅥA族;
(2)X的一种同位素可用于测定文物年代,该同位素为,故答案为:614C;
(3)Z单质为Cl2,电子式为 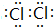 ;Y的氢化物为NH3,其水溶液显碱性的原因为:NH3+H2O?NH3•H2O?NH4++OH-,
;Y的氢化物为NH3,其水溶液显碱性的原因为:NH3+H2O?NH3•H2O?NH4++OH-,
故答案为: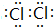 ;NH3+H2O?NH3•H2O?NH4++OH-;
;NH3+H2O?NH3•H2O?NH4++OH-;
(4)同周期自左而右非金属性减弱,Cl元素非金属性比硫的强,
a.物理性质不能说明非金属性强弱,故a错误;
b.氢化物酸性不能比较元素非金属性强弱,故b错误;
c.元素非金属性强弱与获得电子能力强弱有关,与最高正化合价无关,故c错误;
c.非金属性越强,最高价氧化物对应水化物的酸性越强,故d正确;
故答案为:Cl;d.
(5)Z的氢化物为HCl,Y的氢化物为NH3,二者发生化合反应生成NH4Cl,NH4Cl中含有离子键、共价键,
故答案为:离子键、共价键.
点评 本题考查结构性质位置关系综合应用,难度不大,推断元素是解题关键,注意掌握金属性、非金属性强弱比较实验事实.

| A. | c(H2SO3)>c(SO32-) | |
| B. | 溶液中HSO3-电离程度大于水解程度 | |
| C. | 水电离出c(H+)=10-5mol•L-1 | |
| D. | c(Na+ )+c(H+)=c(HSO3-)+c(OH-)+c(SO32-) |
| A. |  稀硫酸 | B. |  稀硫酸 | C. |  酒精 | D. |  稀硫酸 |
| A. | 浓硝酸通常保存在棕色的试剂瓶中,说明浓硝酸不稳定 | |
| B. | 浓硫酸具有吸水性,说明可用浓硫酸干燥氨气 | |
| C. | 足量铁与稀硝酸反应后溶液呈浅绿色,说明稀硝酸不能氧化Fe2+ | |
| D. | 常温下,可用铝制容器盛装浓硫酸,说明浓硫酸与铝不反应 |
| A. | 铀(U)的两种核素:${\;}_{92}^{235}$U和${\;}_{92}^{238}$U | |
| B. | CO2的结构式:O=C=O | |
| C. | 乙醇分子的比例模型: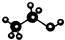 | |
| D. | Cl-结构示意图: |

| A. | Y的气态氢化物与其最高价氧化物水化物能反应生成盐 | |
| B. | X的单质可做半导体和光电纤维材料 | |
| C. | M和Y的最高价氧化物对应水化物之间能相互反应 | |
| D. | Z的气态氢化物比Y的气态氢化物稳定 |
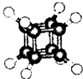
| A. | 它的一氯代物只有一种同分异构体 | |
| B. | 它的二氯代物有三种同分异构体 | |
| C. | 它与苯乙烯(C6H5-CH=CH2)互为同分异构体 | |
| D. | 它是一种不饱和烃,既能发生取代反应,又能发生加成反应 |
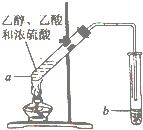 用如图所示的实驗装置制备少置乙酸乙酯.请回答有关问题:
用如图所示的实驗装置制备少置乙酸乙酯.请回答有关问题: CH3COOC2H5+H2O,反应类型是酯化反应(或取代反应).
CH3COOC2H5+H2O,反应类型是酯化反应(或取代反应).