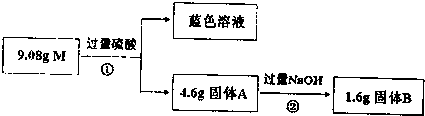
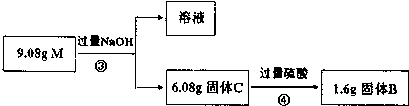
题目内容
17.0.5mol NH3中所含的原子数为2NA,所含的质子数为5NA;含有5mol电子的H2O的物质的量是0.5mol.分析 N原子质子数为7,H原子质子数为1,根据n=$\frac{N}{{N}_{A}}$结合分子、原子构成计算该题.
解答 解:0.5mol NH3中所含的原子数为0.5mol×4×NA/mol=2NA,
含有的质子数为0.5mol×(7+3×1)×NA/mol=5NA,
1mol水含有10mol电子,则含有5mol电子的H2O的物质的量是0.5mol,
故答案为:2NA;5NA;0.5mol.
点评 本题考查物质的量的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握相关计算公式的运用,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.含有非极性共价键的化合物是( )
| A. | CO2 | B. | CaCl2 | C. | C2H6 | D. | NaOH |
8.H2SO3 为二元弱酸,常温下,对于pH=5的NaHSO3溶液的下列说法正确的是( )
| A. | c(H2SO3)>c(SO32-) | |
| B. | 溶液中HSO3-电离程度大于水解程度 | |
| C. | 水电离出c(H+)=10-5mol•L-1 | |
| D. | c(Na+ )+c(H+)=c(HSO3-)+c(OH-)+c(SO32-) |
5.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | agC2H4和C3H6的混合物所含碳氢键数目为$\frac{a{N}_{A}}{7}$ | |
| B. | 2.24L12C18O或14N2所含的电子数为1.4NA | |
| C. | 1L0.1mol/L的CuSO4溶液中含有Cu2+的数目为0.1NA | |
| D. | 25℃时,在PH=12的1.0LBa(OH)2溶液中含有OH-的数目为0.02NA |
2.下列物质中,属于高分子化合物的是( )①蛋白质 ②氨基酸 ③油脂 ④淀粉 ⑤氯乙烯 ⑥纤维素 ⑦聚乙烯.
| A. | ①③④⑥⑦ | B. | 除外②都是 | C. | ①④⑥⑦ | D. | ①③④⑦ |
9.下列各种装置属于原电池的是( )
| A. |  稀硫酸 | B. |  稀硫酸 | C. | 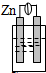 酒精 | D. | 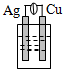 稀硫酸 |
6.对下列事实的解释正确的是( )
| A. | 浓硝酸通常保存在棕色的试剂瓶中,说明浓硝酸不稳定 | |
| B. | 浓硫酸具有吸水性,说明可用浓硫酸干燥氨气 | |
| C. | 足量铁与稀硝酸反应后溶液呈浅绿色,说明稀硝酸不能氧化Fe2+ | |
| D. | 常温下,可用铝制容器盛装浓硫酸,说明浓硫酸与铝不反应 |