题目内容
19.高温下,某反应达平衡,平衡常数K=$\frac{c(CO)•c({H}_{2}O)}{c({C}_{2}O)•c({H}_{2})}$,恒容时,温度升高,H2浓度减小.下列说法正确( )| A. | 升高温度,逆反应速率减小 | |
| B. | 恒温恒容下,增大压强,H2浓度一定减小 | |
| C. | 该反应的焓变为正值 | |
| D. | 该反应化学方程式为CO+H2O═CO2+H2 |
分析 高温下,某反应达平衡,平衡常数K=$\frac{c(CO)•c({H}_{2}O)}{c({C}_{2}O)•c({H}_{2})}$,该反应为CO2+H2?CO+H2O,恒容时,温度升高,H2浓度减小,则该反应为吸热反应,以此来解答.
解答 解:A.升高温度,正逆反应速率都增大,故A错误;
B.恒温恒容下,增大压强,若通入氢气,则H2浓度增大,故B错误;
C.恒容时,温度升高,H2浓度减小,则该反应为吸热反应,所以△H>0,故C正确;
D.由平衡常数可知,该反应为CO2+H2?CO+H2O,故D错误;
故选C.
点评 本题考查影响化学平衡的因素,明确平衡常数与化学反应的关系及温度对化学平衡的影响即可解答,题目难度不大.

练习册系列答案
相关题目
15.在烧杯中混合Ba(OH)2•8H2O与NH4Cl晶体,下列现象不能说明该反应是吸热反应的是( )
| A. | 有使湿润的pH试纸变蓝的气体产生 | |
| B. | 滴有水滴的玻璃片冻结在烧杯底部 | |
| C. | 盛有饱和硝酸钾溶液的试管置于反应混合物内,拿出后发现溶液浑浊 | |
| D. | 烧杯外壁有水珠凝结 |
7.含有非极性共价键的化合物是( )
| A. | CO2 | B. | CaCl2 | C. | C2H6 | D. | NaOH |
11.燃料电池是一种新型电池,它主要是利用燃料燃烧原理把化学能直接转化为电能.氢氧燃料电池的基本反应是:X极:$\frac{1}{2}$O2(g)+H2O(l)+2e-═2OH-;Y极:H2(g)+2OH--2e-═2H2O(l).下列说法正确的是( )
| A. | X是正极 | B. | Y是正极 | ||
| C. | Y极发生还原反应 | D. | 电子由X极移向Y极 |
8.H2SO3 为二元弱酸,常温下,对于pH=5的NaHSO3溶液的下列说法正确的是( )
| A. | c(H2SO3)>c(SO32-) | |
| B. | 溶液中HSO3-电离程度大于水解程度 | |
| C. | 水电离出c(H+)=10-5mol•L-1 | |
| D. | c(Na+ )+c(H+)=c(HSO3-)+c(OH-)+c(SO32-) |
9.下列各种装置属于原电池的是( )
| A. | 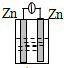 稀硫酸 | B. | 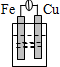 稀硫酸 | C. | 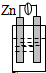 酒精 | D. | 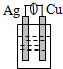 稀硫酸 |
