题目内容
【题目】CO是生产羰基化学品的基本原料,对于以水煤气为原料提取CO的工艺,如果氢气未能充分利用,则提高了CO生产成本,所以在煤化工中常需研究不同温度下的平衡常数、投料比及热值问题.反应CO(g)+H2O(g)H2(g)+CO2(g)的平衡常数随温度的变化如表:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | a |
(1)上述反应的逆反应是 ______ (填“放热”或“吸热”)反应.
(2)已知在一定温度下:C(s)+CO2(g)2CO(g)K
C(s)+H2O(g)H2(g)+CO(g)K1
CO(g)+H2O(g)H2(g)+CO2(g)K2
则K、K1、K2、之间的关系是 ______ .
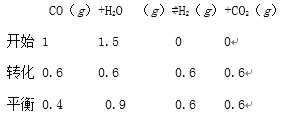
(3)800℃时,在2L的恒容密闭容器中,充入2.0molCO(g)和3.0molH2O(g),保持温度不变进行反应:CO(g)+H2O(g)H2(g)+CO2(g),4min时反应达到平衡,测得CO的转化率为60%.
①0~4min内,CO2的平均反应速率为 ______ molL-1min-1,800℃时a= ______ .
②800℃时四个不同容器中发生上述反应,测得各物质的浓度(molL-1)如表,其中达到平衡状态的是 ______ (填字母).
A | B | C | D | |
c(CO2) | 3 | 1 | 0.8 | 1 |
c(H2) | 2 | 1 | 0.8 | 1 |
c(CO) | 1 | 2 | 3 | 0.5 |
c(H2O) | 2 | 2 | 3 | 2 |
【答案】 吸热 K=![]() 0.15 1 D
0.15 1 D
【解析】试题分析:(1)根据表格数据,升高温度K减小,平衡逆向移动,正反应放热;(2)根据平衡常数表达式判断K、K1、K2、之间的关系;(3)根据“三段式”计算
①0~4min内,CO2的平均反应速率为,800℃时平衡常数.
②根据Q、K的关系判断是否达到平衡状态。
解析:升高温度K减小,平衡逆向移动,正反应放热,所以逆反应吸热;
(2)根据平衡常数表达式K=![]() 、K1=
、K1=![]() 、K2=
、K2=![]() ;所以K=
;所以K=![]() ;
;
(3) 
①0~4min内,CO2的平均反应速率为![]() 0.15 molL-1min-1;800℃时a=
0.15 molL-1min-1;800℃时a=![]() =
=![]() 1;
1;
②A、B、C、D的Q值分别为A、![]() ;B、
;B、![]() ;C、
;C、![]() ;D、
;D、![]() ,只有D中Q=K,故D达到平衡状态。
,只有D中Q=K,故D达到平衡状态。