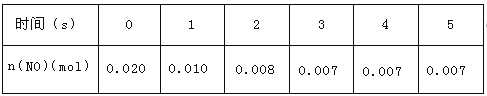
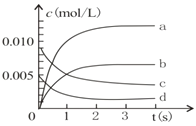
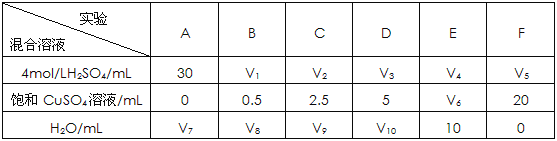
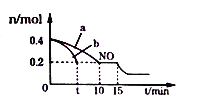
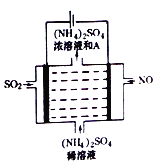
题目内容
【题目】研究电化学腐蚀及防护的装置如图所示。下列有关说法错误的是
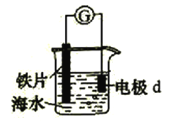
A. d为石墨,铁片腐蚀加快
B. d为石墨,石墨上电极反应为:O2+ 2H2O + 4e = 4OH–
C. d为锌块,铁片不易被腐蚀
D. d为锌块,铁片上电极反应为:2H++ 2e = H2↑
【答案】D
【解析】A、由于活动性:Fe>石墨,所以铁、石墨及海水构成原电池,Fe为负极,失去电子被氧化变为Fe2+进入溶液,溶解在海水中的氧气在正极石墨上得到电子被还原,比没有形成原电池时的速率快,选项A正确;B、d为石墨,由于是中性电解质,所以发生的是吸氧腐蚀,石墨上氧气得到电子,发生还原反应,电极反应为:O2 + 2H2O + 4e-→ 4OH–,选项B正确;C、若d为锌块,则由于金属活动性:Zn>Fe,Zn为原电池的负极,Fe为正极,首先被腐蚀的是Zn,铁得到保护,铁片不易被腐蚀,选项C正确;D、d为锌块,由于电解质为中性环境,发生的是吸氧腐蚀,在铁片上电极反应为:O2 + 2H2O + 4e-→ 4OH–,选项D错误。答案选D。

练习册系列答案
相关题目