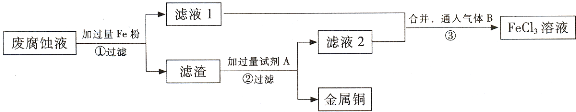
题目内容
a g铁粉与含有H2SO4的CuSO4溶液完全反应后,得到a g铜,则参与反应的CuSO4与
 H2SO4的物质的量之比为 ( )
H2SO4的物质的量之比为 ( )

 H2SO4的物质的量之比为 ( )
H2SO4的物质的量之比为 ( )
| A.1 :7 | B.7 :1 | C.7 :8 | D.8 :7 |
B
 根据题意可以知道,铁粉完全反应且反应前后固体的质量不变,因此设参加反应的CuSO4与H2SO4的物质的量分别为x和y,则:
根据题意可以知道,铁粉完全反应且反应前后固体的质量不变,因此设参加反应的CuSO4与H2SO4的物质的量分别为x和y,则: Fe +CuSO4 =" " FeSO4+Cu △m
Fe +CuSO4 =" " FeSO4+Cu △m 1mol 56g
1mol 56g x 56 x g·mol-1
x 56 x g·mol-1 Fe +H2SO4 =" " FeSO4+H2↑ △m
Fe +H2SO4 =" " FeSO4+H2↑ △m 1mol 8g
1mol 8g y 8 y g·mol-1
y 8 y g·mol-1 因反应前后固体的质量没有发生变化,因此第一个反应质量的减小等于第二个反应质量的增加,即56x g·mol-1="8" y g·mol-1,所以
因反应前后固体的质量没有发生变化,因此第一个反应质量的减小等于第二个反应质量的增加,即56x g·mol-1="8" y g·mol-1,所以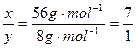 。
。
练习册系列答案
相关题目
 为了测定一定质量的铜铝混合物中铜的质量分数,某化学课外活动小组设计了如下两个方案:
为了测定一定质量的铜铝混合物中铜的质量分数,某化学课外活动小组设计了如下两个方案:
 仅限选择的仪器和试剂:烧杯、试管、玻璃棒、量筒、容量瓶、滴管、药匙;1mol·L-1硫酸、2mol·L-2硝酸、2mol·NaOH溶液、20%KSCN溶液。
仅限选择的仪器和试剂:烧杯、试管、玻璃棒、量筒、容量瓶、滴管、药匙;1mol·L-1硫酸、2mol·L-2硝酸、2mol·NaOH溶液、20%KSCN溶液。