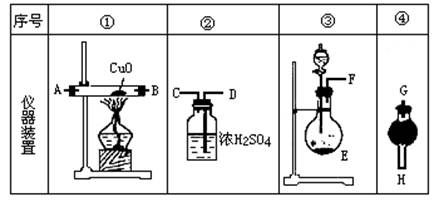
��Ŀ����
��I�����ӹ�ҵ����30%��FeCl3��Һ��ʴ���ھ�Ե���ϵ�ͭ��������ӡˢ��·�壮��FeCl3��Һ����ʴҺ��Cu��Ӧ����CuCl2��FeCl2��
��1��д���÷�Ӧ�Ļ�ѧ����ʽ______��
��2��������Һ��Fe3+���ڵ��Լ���______��֤��Fe3+���ڵ�������______��
����ӡˢ��·�ķϸ�ʴҺ���д���CuCl2��FeCl2��FeCl3�������ŷŻ���ɻ�����Ⱦ����Դ���˷ѣ�ͨ���������̿ɴӸ÷�Һ�л���ͭ���������Ļ�����ȫ��ת��ΪFeCl3��Һ����Ϊ��ʴҺԭ��ѭ��ʹ�ã�
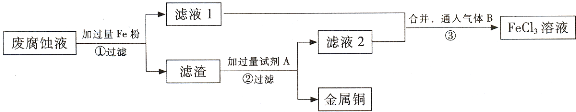
��1��������з�����Ӧ�����ӷ���ʽ______��
��2��������������Լ�A��______���ѧʽ����
��3�������ͨ�������B��______���ѧʽ����д���÷�Ӧ�Ļ�ѧ����ʽ______��
��4��Ϊ�ⶨ������ͭ������������ȡ50g���������������Լ�A��Ӧ���õ�5.6L���壨��״���£����Լ���������ͭ��������������д��������̣�
��1��д���÷�Ӧ�Ļ�ѧ����ʽ______��
��2��������Һ��Fe3+���ڵ��Լ���______��֤��Fe3+���ڵ�������______��
����ӡˢ��·�ķϸ�ʴҺ���д���CuCl2��FeCl2��FeCl3�������ŷŻ���ɻ�����Ⱦ����Դ���˷ѣ�ͨ���������̿ɴӸ÷�Һ�л���ͭ���������Ļ�����ȫ��ת��ΪFeCl3��Һ����Ϊ��ʴҺԭ��ѭ��ʹ�ã�

��1��������з�����Ӧ�����ӷ���ʽ______��
��2��������������Լ�A��______���ѧʽ����
��3�������ͨ�������B��______���ѧʽ����д���÷�Ӧ�Ļ�ѧ����ʽ______��
��4��Ϊ�ⶨ������ͭ������������ȡ50g���������������Լ�A��Ӧ���õ�5.6L���壨��״���£����Լ���������ͭ��������������д��������̣�
��I����1���Ȼ�����ͭ��Ӧ�����Ȼ��������Ȼ�������Ӧ����ʽΪ��2FeCl3+Cu�T2FeCl2+CuCl2��
�ʴ�Ϊ��2FeCl3+Cu�T2FeCl2+CuCl2��
��2��������Һ��Fe3+����ͨ����KSCN��Һ��ȡ������Һ���Թ��У��μ�KSCN��Һ��������ӦFe3++3SCN-?Fe��SCN��3����Һ��죬˵��Fe3+���ڣ�
�ʴ�Ϊ��KSCN��Һ����Һ���ɫ��
����ӡˢ��·�ķϸ�ʴҺ�е�CuCl2��FeCl3�����۷�Ӧ����Fe2+��Cu��CuCl2�����۷�Ӧ�����ӷ���ʽΪ��Fe+Cu2+=Fe2++Cu��FeCl3�����۷�Ӧ�����ӷ���ʽΪ��2Fe3+++Fe=3Fe2+���ʴ�Ϊ��2Fe3++Fe=3Fe2+��Fe+Cu2+=Fe2++Cu��
��2�������к���Fe��Cu����Ҫ��ȥ���е�Feѡ�����ᣬȻ����ˣ��ʴ�Ϊ��HCl��
��3���ϸ�ʴҺ�����ۺ���ҺΪ�������ӵ���Һ��ͨ�������õ����Ȼ�����Һ���䷴Ӧ�Ļ�ѧ����ʽΪ��2FeCl2+C12=2FeCl3���ʴ�Ϊ��C12��2FeCl2+C12=2FeCl3��
��4��ȡ50g��������������HCl��Ӧ���õ�5.6L��������n��H2��=
=0.25mol����֪�����ķ�Ӧ����ʽΪFe+2HC1=FeCl2+H2��������n��Fe��=0.25mol��m��Fe��=nM=0.25mol��56g/mol=14g����m��Cu��=50-14=36g������������ͭ����������Ϊ
��100%=72%��
��������ͭ����������Ϊ72%��
�ʴ�Ϊ��2FeCl3+Cu�T2FeCl2+CuCl2��
��2��������Һ��Fe3+����ͨ����KSCN��Һ��ȡ������Һ���Թ��У��μ�KSCN��Һ��������ӦFe3++3SCN-?Fe��SCN��3����Һ��죬˵��Fe3+���ڣ�
�ʴ�Ϊ��KSCN��Һ����Һ���ɫ��
����ӡˢ��·�ķϸ�ʴҺ�е�CuCl2��FeCl3�����۷�Ӧ����Fe2+��Cu��CuCl2�����۷�Ӧ�����ӷ���ʽΪ��Fe+Cu2+=Fe2++Cu��FeCl3�����۷�Ӧ�����ӷ���ʽΪ��2Fe3+++Fe=3Fe2+���ʴ�Ϊ��2Fe3++Fe=3Fe2+��Fe+Cu2+=Fe2++Cu��
��2�������к���Fe��Cu����Ҫ��ȥ���е�Feѡ�����ᣬȻ����ˣ��ʴ�Ϊ��HCl��
��3���ϸ�ʴҺ�����ۺ���ҺΪ�������ӵ���Һ��ͨ�������õ����Ȼ�����Һ���䷴Ӧ�Ļ�ѧ����ʽΪ��2FeCl2+C12=2FeCl3���ʴ�Ϊ��C12��2FeCl2+C12=2FeCl3��
��4��ȡ50g��������������HCl��Ӧ���õ�5.6L��������n��H2��=
| 5.6L |
| 22.4mol/L |
| 36g |
| 50g |
��������ͭ����������Ϊ72%��

��ϰ��ϵ�д�
 ��У����ϵ�д�
��У����ϵ�д�
�����Ŀ
 H2SO4�����ʵ���֮��Ϊ �� ��
H2SO4�����ʵ���֮��Ϊ �� ��