题目内容
将22.4g铜粉与三氧化二铁的混合粉末,加入1mol/L的硫酸中进行反应。
(1)若固体恰好全部溶解,消耗硫酸的体积为VL,求V的取值范围。
(2)若硫酸溶液过量,反应后溶液的体积为1L,测得此溶液中Fe2+的浓度为0.1mol/L,求此混合物中含铜多少克?
(1)若固体恰好全部溶解,消耗硫酸的体积为VL,求V的取值范围。
(2)若硫酸溶液过量,反应后溶液的体积为1L,测得此溶液中Fe2+的浓度为0.1mol/L,求此混合物中含铜多少克?
(1)0.3L≤V<0.42L (2)14.4g或3.2g。
(1)若铜粉和三氧化二铁的混合物是按如下反应进行:
Fe2O3 + 3H2SO4 = Fe2 (SO4)3 + 3H2O
Cu + Fe2 (SO4)3 = 2FeSO4 + CuSO4
 Cu+Fe2O3+3H2SO4= CuSO4+2FeSO4+3H2O
Cu+Fe2O3+3H2SO4= CuSO4+2FeSO4+3H2O
1 mol铜和1 mol Fe2O3为224 g,22.4 g可看作0.1 mol,需要硫酸0.3 mol,
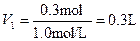 。
。
若混合物粉末全是Fe2O3,则有
Fe2O3 + 3H2SO4 = Fe2 (SO4)3 + 3H2O
n (Fe2O3) =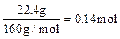 ,H2SO4为0.14 mol×3 = 0.42 mol,
,H2SO4为0.14 mol×3 = 0.42 mol,
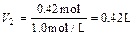 。
。
但铜的质量不可能为0,故有0.3L≤V<0.42L。
(2)若铜过量,过量的铜不与硫酸反应,则只发生如下反应:
Cu+Fe2O3+3H2SO4= CuSO4+2FeSO4+3H2O
0.05 0.05 0.1
m (Fe2O3) = 0.05 mol×160 g / mol = 8.0 g,m (Cu) = 22.4 g-8.0 g= 14.4 g。
若Fe2O3过量,过量的Fe2O3将与H2SO4反应,则m (Cu)=0.05mol×64 g / mol =3.2g。
Fe2O3 + 3H2SO4 = Fe2 (SO4)3 + 3H2O
Cu + Fe2 (SO4)3 = 2FeSO4 + CuSO4
 Cu+Fe2O3+3H2SO4= CuSO4+2FeSO4+3H2O
Cu+Fe2O3+3H2SO4= CuSO4+2FeSO4+3H2O1 mol铜和1 mol Fe2O3为224 g,22.4 g可看作0.1 mol,需要硫酸0.3 mol,
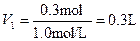 。
。若混合物粉末全是Fe2O3,则有
Fe2O3 + 3H2SO4 = Fe2 (SO4)3 + 3H2O
n (Fe2O3) =
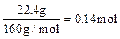 ,H2SO4为0.14 mol×3 = 0.42 mol,
,H2SO4为0.14 mol×3 = 0.42 mol,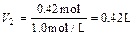 。
。但铜的质量不可能为0,故有0.3L≤V<0.42L。
(2)若铜过量,过量的铜不与硫酸反应,则只发生如下反应:
Cu+Fe2O3+3H2SO4= CuSO4+2FeSO4+3H2O
0.05 0.05 0.1
m (Fe2O3) = 0.05 mol×160 g / mol = 8.0 g,m (Cu) = 22.4 g-8.0 g= 14.4 g。
若Fe2O3过量,过量的Fe2O3将与H2SO4反应,则m (Cu)=0.05mol×64 g / mol =3.2g。

练习册系列答案
相关题目
 H2SO4的物质的量之比为 ( )
H2SO4的物质的量之比为 ( )