��Ŀ����
����Ŀ��ijʵ��С��������װ�ý����Ҵ���������ʵ�顣
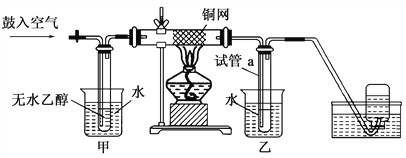
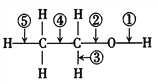
��1��ʵ�������ͭ�����ֺ�ɫ�ͺ�ɫ�����������д����Ӧ�Ļ�ѧ��Ӧ����ʽ��___________________���ڲ��Ϲ������������£�Ϩ��ƾ��ƣ���Ӧ���ܼ������У�˵�����Ҵ���������Ӧ��________��Ӧ��
��2����������ˮԡ���ò���ͬ����������________���ҵ�������________��
��3����Ӧ����һ��ʱ������Թ�a�����ռ�����ͬ�����ʣ����Թ�a���ռ�����Һ������ɫʯ����ֽ���飬��ֽ�Ժ�ɫ��˵��Һ���л�����________��Ҫ��ȥ�����ʣ������ڻ��Һ�м���________(��д��ĸ)��
a���Ȼ�����Һ��������b���� c��̼��������Һ d�����Ȼ�̼
Ȼ����ͨ��________(��ʵ���������)���ɳ�ȥ��
���𰸡� 2Cu��O2![]() 2CuO��CH3CH2OH��CuO
2CuO��CH3CH2OH��CuO![]() CH3CHO��Cu��H2O ���� ���� ��ȴ ���� c ����
CH3CHO��Cu��H2O ���� ���� ��ȴ ���� c ����
��������(1)�Ҵ��Ĵ�������Ӧ���̣�����ͭ����������Ϊ����ͭ��2Cu+O2![]() 2CuO������ͭ���Ҵ�����Ϊ��ȩ��CH3CH2OH+CuO
2CuO������ͭ���Ҵ�����Ϊ��ȩ��CH3CH2OH+CuO![]() CH3CHO+Cu+H2O��
CH3CHO+Cu+H2O��
(2)���ݷ�Ӧ���̿�֪���ڼ״�����ˮԡ����ʹ�Ҵ��ӷ�������е�������ϣ���������һ����Ӧ���Ҵ�����Ϊ��ˮԡ�������¶ȣ�ʹ���ɵ���ȩ������ΪҺ�壬�����Թܵĵײ���
(3)���Թ�a���ռ�����Һ������ɫʯ����ֽ���飬��ֽ�Ժ�ɫ��˵��Һ���л��������ᣬ�ĸ�ѡ����У�ֻ��C�������ƿ��Ժ����ᷴӦ�����������ơ�ˮ�Ͷ�����̼��ʵ�����ֻ������ʵķ���������

 ��У����ϵ�д�
��У����ϵ�д�