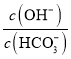题目内容
【题目】就教材中“氢氧化铁胶体”的制备实验,回答以下几个问题。
(1)制备氢氧化铁胶体的操作______________________。
(2)证明有氢氧化铁胶体生成的实验操作(答名称)_______
(3)往沸水中滴加饱和氯化铁溶液后,可稍微加热煮沸,但不宜长时间加热。这样操作的原因是__________________________________。
(4)写出制备的化学方程式:______________________________________。
【答案】 向25mL沸腾的蒸馏水中逐滴加入5~6滴饱和FeCl3溶液,继续煮沸待溶液呈红褐色后,停止加热 丁达尔效应 长时间的加热能够导致氢氧化铁胶体聚沉 FeCl3+3H2O=Fe(OH)3(胶体)+3HCl
【解析】(1)制备氢氧化铁胶体的操作为向25mL沸腾的蒸馏水中逐滴加入5~6滴饱和FeCl3溶液,继续煮沸待溶液呈红褐色后,停止加热。(2)胶体能产生丁达尔效应,证明有氢氧化铁胶体生成的实验操作为丁达尔效应。(3)加热容易使胶体发生聚沉,所以往沸水中滴加饱和氯化铁溶液后,可稍微加热煮沸,但不宜长时间加热。(4)反应的化学方程式为FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl。
Fe(OH)3(胶体)+3HCl。

【题目】下列物质的性质与实际应用的对应关系正确的是
选项 | 物质的性质 | 实际应用 |
A | 液氨具有碱性 | 作冷库中的制冷剂 |
B | FeCl3水溶液显酸性 | 蚀刻铜制线路板 |
C | 石墨具有导电性 | 作干电池正极材料 |
D | Al2O3是两性氧化物 | 作耐火材料 |
A. AB. BC. CD. D
【题目】室温下,将0.05 mol Na2CO3固体溶于水配成100mL溶液,向溶液中加入下列物质。有关结论正确的是 ( )
加入的物质 | 结论 | |
A | 50mL 1 mol·L-1H2SO4 | 反应结束后,c(Na+)=c(SO42-) |
B | 0.1molNaHSO4固体 | 反应完全后,溶液pH减小,c(Na+)不变 |
C | 50mL H2O | 由水电离出的c(H+)·c(OH—)不变 |
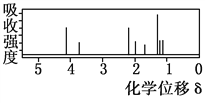
D | 0.05molCaO | 溶液中 |
A. A B. B C. C D. D