题目内容
【题目】A 、B 、C 、D 、E是原子序数依次增加的短周期元素。
已知A是形成化合物种类最多的元素, B的第一电离能至第四电离能分别是932kJ·mol-1、1821kJ·mol-1、15390kJ·mol-1、21771kJ·mol-1;C元素原子核外最外层成对电子对数与其单电子数相等;D元素的常见单质的键能是双原子分子中最大的;E的氧化物是光电纤维的成分。F位于周期表中第四周期IIB族。回答下列问题:

(1)F元素原子的外围电子排布式____.在F元素的硫酸盐中逐滴滴入NaOH溶液至过量得到透明澄清的无色溶液,该溶液中含有一种带两个单位负电荷的配离子,则F元素的硫酸盐与过量NaOH溶液反应的化学方程式为_____
(2)B与氯元素形成的化合物的立体构型为_____
(3)C元素可形成多种单质。其中是一种单质的分子式为C60 则C60的为_____晶体,在该晶体中每个C原子只与相邻的3个C原子形成化学键,C60分子中只含有五边形和六边形。其结构如图1所示。则1molC60分子中含______molσ键
(4)A、C 、D三元素形成的一种分子,其化学式为 A6C3D6,该分子结构与苯相似,其结构中含有三个-DA2,则A6C3D6的结构简式为_____。该分子中电负性最大的元素的杂化轨道类型是_____
(5)C与 E两元素空间网状结构的晶体。其晶胞如图2所示。查阅资料可知该晶体的熔点低于金刚石,其理由是____,若该晶胞边长为a cm,碳原子直径为b cm,硅原子直径为c cm,则该晶胞的空间利用率为_______(用含a.b.c的式子表示)。
【答案】 3d104s2 ZnSO4+4NaOH=Na2〔Zn(OH)4〕+ Na2SO4 直线形 分子 90 ![]() sp2、sp3 两者都是原子晶体,C-Si键长长于C-C键长
sp2、sp3 两者都是原子晶体,C-Si键长长于C-C键长 ![]() ×100%
×100%
【解析】A 、B 、C 、D 、E是原子序数依次增加的短周期元素。A是形成化合物种类最多的元素,A为H元素; B的第一电离能至第四电离能分别是932kJ·mol-1、1821kJ·mol-1、15390kJ·mol-1、21771kJ·mol-1,则B为第ⅡA族元素,为Be元素;C元素原子核外最外层中成对电子对数与其单电子数相等,则C为C元素;D元素的常见单质的键能是双原子分子中最大的,D为N元素;E的氧化物是光电纤维的成分,E为Si元素,F位于周期表中第四周期IIB族,F为Zn元素。
(1)F为Zn元素,Zn原子的外围电子排布式为3d104s2,在硫酸锌中逐滴滴入NaOH溶液至过量得到透明澄清的无色溶液,该溶液中含有一种带两个单位负电荷的配离子,反应的化学方程式为ZnSO4+4NaOH=Na2〔Zn(OH)4〕+ Na2SO4,故答案为:3d104s2;ZnSO4+4NaOH=Na2〔Zn(OH)4〕+ Na2SO4;
(2)B 为Be元素,与氯元素形成的化合物为BeCl2,其中Be的价层电子对数为2,没有孤电子对,立体构型为直线形,故答案为:直线形;
(3)该单质的分子式为C60 则C60的为分子晶体;分子中每个碳原子只跟相邻的3个碳原子形成化学键,根据C的四价原理可知,每个碳原子形成2个单键和1个双键,根据均分法,每个碳原子含有![]() 个共价键,则60个碳原子含有90个共价键,则1molC60分子中含90molσ键,故答案为:分子;90;
个共价键,则60个碳原子含有90个共价键,则1molC60分子中含90molσ键,故答案为:分子;90;
(4)A、C 、D三元素形成的一种分子,其化学式为 H6C3N6,该分子结构与苯相似,其结构中含有三个-NH2,则H6C3N6的结构简式为![]() 。元素的非金属性越强,电负性越大,该分子中电负性最大的元素是N,分子中N原子有2种,其中-NH2中N原子的价层电子对数为3+
。元素的非金属性越强,电负性越大,该分子中电负性最大的元素是N,分子中N原子有2种,其中-NH2中N原子的价层电子对数为3+![]() ×(5-1×2-1)=4,采用sp3杂化,=N-中的N原子的价层电子对数为2+
×(5-1×2-1)=4,采用sp3杂化,=N-中的N原子的价层电子对数为2+![]() ×(5-3)=3,采用sp2杂化,故答案为:
×(5-3)=3,采用sp2杂化,故答案为:![]() ;sp2、sp3;
;sp2、sp3;
(5)根据均摊法计算晶胞中Si原子数目=8×![]() +6×
+6×![]() =4、C原子数目=4,晶胞边长为a cm,则晶胞体积为a3cm3,碳原子直径为b cm,则晶胞中C原子总体积=4×
=4、C原子数目=4,晶胞边长为a cm,则晶胞体积为a3cm3,碳原子直径为b cm,则晶胞中C原子总体积=4×![]() ×π×(
×π×( ![]() b)3cm3=
b)3cm3=![]() πb3cm3,硅原子直径为c cm,则晶胞中Si原子总体积=4×
πb3cm3,硅原子直径为c cm,则晶胞中Si原子总体积=4×![]() ×π×(
×π×(![]() c)3cm3=
c)3cm3=![]() πc3cm3,故晶胞中C、Si原子总体积=
πc3cm3,故晶胞中C、Si原子总体积=![]() πb3cm3+
πb3cm3+![]() πb3cm3=
πb3cm3=![]() π(b3+c3)cm3,故晶胞的空间利用率=
π(b3+c3)cm3,故晶胞的空间利用率=![]() ×100%=
×100%=![]() ×100%,故答案为:两者都是原子晶体,C-Si键长长于C-C键长;
×100%,故答案为:两者都是原子晶体,C-Si键长长于C-C键长;![]() ×100%。
×100%。

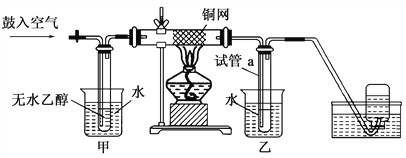
【题目】某校化学兴趣小组探究SO2的一些性质。
[探究一]:SO2能否被BaCl2溶液吸收。

甲、乙两同学分别设计如下装置甲和装置乙进行探究
甲、乙两同学实验时观察到各仪器中的现象如下:
A | B | C | D | |
装置甲中的现象 | Na2SO3固体表面有气泡.瓶中白雾 | 白色沉淀 | ----- | ------ |
装置乙中的现象 | Na2SO3固体表面有气泡.瓶中白雾 | 有气泡 | 有气泡 | 品红褪色 |
回答下列问题:
(1)甲同学经过后续实验确证了B中白色沉淀是BaSO4.甲同学的后续实验操作是____
(2)乙同学分析装置甲中产生BaSO4的可能原因有:
①A中产生的白雾是硫酸的酸雾,进入B中与BaCl2溶液反应生成BaSO4沉淀。
②________________________(用离子方程式表示)。
(3)装置乙中B中所盛试剂是___;乙同学在滴加浓硫酸之前的操作是___________
(4)通过上述实验,得出的结论是________________________
[探究二]:SO2与FeCl3溶液的反应
查阅资料:①Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+;②生成Fe(HSO3)2+离子的反应为可逆反应。实验步骤为:
步骤I | 往5mL1mol·L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色。微热3 min,溶液颜色变为浅绿色。 |
步骤II | 往5mL重新配制的1mol·L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色。几分钟后,发现溶液颜色变成浅绿色。 |
回答下列问题:
(5)当SO2通入到FeCl3(未用盐酸酸化)溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象。将混合液放置12小时,溶液才变成浅绿色。则溶液由棕黄色变成红棕色的原因是_________;写出溶液由红棕色变为浅绿色时发生反应的离子方程式___________
(6)通过实验可知_____和________可缩短浅绿色出现的时间。
【题目】几种短周期元素的原子半径及主要化合价如下表:
元素符号 | A | B | C | D | E |
原子半径(nm) | 0.160 | 0.080 | X | 0.143 | 0.074 |
主要化合价 | +2 | +2 | -2,+4,+6 | +3 | -2 |
则X可能的数值为
A. 0.069 B. 0.102 C. 0.145 D. 0.184