题目内容
【题目】X、Y、Z均为短周期元素,其中两种为金属元素,一种为非金属元素,其原子半径分别为
X | Y | Z | |
原子半径/nm | 0.154 | 0.130 | 0.071 |
X、Y处于同一周期,三种元素形成的简单离子具有相同的电子层结构。下列说法正确的是
A. 原子最外层电子数:Z>X>Y
B. 三种元素可能为同周期元素
C. 原子序数:Y>X>Z
D. 离子半径:X>Y>Z
【答案】C
【解析】
X、Y、Z均为短周期元素,其中两种为金属元素,一种为非金属元素,结合原子半径及X、Y处于同一周期,三种元素形成的简单离子具有相同的电子层结构,则三种元素在周期表中相对位置为![]() ,最外层电子数Z>Y>X,故A、B错误;
,最外层电子数Z>Y>X,故A、B错误;
由位置可知,原子序数Y>X>Z,故C正确;
具有相同电子层结构的离子,原子序数大的离子半径小,则离子半径Z>X>Y,故D错误。
故选C。

 小题狂做系列答案
小题狂做系列答案【题目】(1)在2L密闭容器中,起始投入4 molN2和6molH2在一定条件下生成NH3,平衡时仅改变温度测得的数据如表所示(已知:T1<T2)
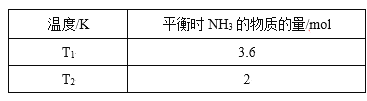
①则K1______K2,(填“>”、“<”或“=”)原因:_______。
②在T2下,经过10s达到化学平衡状态,则0~10s内N2的平均速率v(N2)为______,平衡时H2的转化率为______。若再同时增加各物质的量为1 mol,该反应的平衡V正_____V逆,(>或=或<)平衡常数将_____(填“增大”、“减小”或“不变”)
③下列能说明该反应已达到平衡状态的是___。
A.3v(H2)正=2v(NH3)逆 B.容器内气体压强不变
C.混合气体的平均相对分子质量不再改变的状态 D.△H保持不变
(2)已知下列化学键的键能写出工业上制氨的热化学方程式:
化学键 | H-H | N≡N | N-H |
键能/kJ·mol-1 | 430 | 936 | 390 |
热化学方程式:__________。
(3)下列是科研小组设计的一个氮氧化物原电池,两边的阴影部分为a,b惰性电极,分别用导线与烧杯的m,n(惰性电极)相连接,工作原理示意图如图:
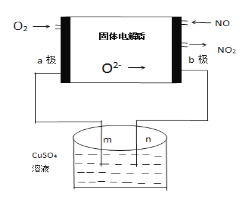
①a为___极,b极的电极反应式____________。
②在标准状况下,通入112mL的O2,可观察到烧杯中n处有_____生成,(假设烧杯中的溶液的体积为200mL,体积不变)最后反应终止时烧杯中溶液的PH为______。