题目内容
已知:
①向KMnO4晶体中滴加浓盐酸,产生某黄绿色气体;
②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。
下列判断中正确的是( )
| A.①中产生气体的电子式是Cl?Cl |
| B.上述实验中,共有两个氧化还原反应 |
| C.实验②中FeCl2被氧化 |
| D.实验③发生的是同主族元素单质间的置换反应 |
C
解析

 阅读快车系列答案
阅读快车系列答案科学家最近用金属钠还原CCl4和SiCl4制得一种一维SiC纳米捧。相关反应的化学方程式为:8Na+CCl4十SiCl4=SiC十8NaCl。下列说法不正确的是( )
| A.一维SiC纳米棒“比表面积”大,对微小粒子有较强的吸附能力 |
| B.上述反应中SiC既是氧化产物又是还原产物 |
| C.SiCl4是由极性键构成的非极性分子 |
| D.CCl4分子、SiCl4分子、SiC晶体中各原子都达到了8电子稳定结构 |
氧化还原反应与四种基本类型反应的关系如右图所示,则下列化学反应属于4区的是( )。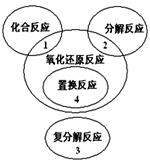
| A.Cl2+2KBr=Br2+2KCl |
| B.2NaHCO3=Na2CO3+H2O+CO2 |
| C.4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
| D.2Na2O2+2CO2=2Na2CO3+O2 |
液态金属汞常温下即可蒸发,其蒸气有剧毒, 实验室为监测空气中汞蒸气的含量,通常悬挂有CuI的滤纸,根据滤纸是否变色或颜色发生变化的时间来判断空气中汞的含量,其反应为:
4CuI+Hg= Cu2HgI4+2Cu(I的化合价反应前后均为-1价的)。下列有关说法不正确的是( )
| A.上述反应的产物Cu2HgI4中,Hg的化合价为+2 |
| B.上述反应中氧化剂是CuI |
| C.上述反应中Cu元素仅有一半被还原 |
| D.上述反应中生成64gCu时,转移的电子数为2NA |
古代曾用绿矾加强热得到硫酸、红色粉末和有刺激性气味的气体,此反应属于( )
| A.有氧化还原的分解反应 |
| B.无氧化还原的分解反应 |
| C.只是氧化还原反应 |
| D.只是分解反应 |
下图是利用钛白粉生产海绵钛(Ti)的一种工艺流程:
有关说法正确的是( )
| A.反应Ⅰ中钛白粉(TiO2)做氧化剂 |
| B.该工艺中可以循环使用的物质只有Cl2 |
| C.可以用N2代替Ar作为反应Ⅱ中的保护气 |
D.反应Ⅱ的化学方程式为2Mg+TiCl4 2MgCl2+Ti 2MgCl2+Ti |
ClO2是一种杀菌消毒效率高的水处理剂,实验室可通过以下反应制得:2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法中不正确的是( )
| A.ClO2是还原产物 |
| B.1 mol KClO3参加反应,失去电子为1 mol |
| C.H2C2O4在反应中被氧化 |
| D.H2C2O4的还原性大于ClO2的还原性 |
向一定量的Fe、FeO和Fe2O3的混合物中加入120 mL 4 mol·L-1的稀硝酸,恰好使混合物完全溶解,放出1.344 L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现。若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为( )
| A.0.24 mol | B.0.16 mol | C.0.21 mol | D.0.14 mol |
已知:金属铈(稀土元素)在空气中易氧化变暗,受热时燃烧,遇水很快反应。(注:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+)下列说法正确的是( )
| A.铈溶于氢碘酸的化学方程式可表示为Ce+4HI=CeI4+2H2↑ |
| B.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++2Fe2+=Ce3++2Fe3+ |
| C.在一定条件下,电解熔融状态的CeO2制Ce,在阴极获得铈 |
D.四种铈的核素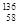 Ce、 Ce、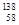 Ce、 Ce、 Ce、 Ce、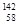 Ce,它们互称为同素异形体 Ce,它们互称为同素异形体 |