题目内容
10.化学反应可视为旧化学键断裂和新化学键形成的过程.化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知:N≡N键的键能是a kJ•mol-1,H-H键的键能是b kJ•mol-1;由N2和H2合成1mol NH3时可放出ckJ的热量.那么N-H键的键能是( )| A. | $\frac{(a+3b-2c)}{2}$kJ•mol-1 | B. | $\frac{(a+3b+2c)}{6}$kJ•mol-1 | ||
| C. | $\frac{(a+3b-2c)}{6}$kJ•mol-1 | D. | $\frac{(a+3b+2c)}{3}$kJ•mol-1 |
分析 根据断裂旧键要吸热,形成新键要放热,反应热△H=反应物的总键能-生成物的总键能计算.
解答 解:N2和H2合成NH3的方程式为:N2+3H2?2NH3,N-H键的键能为x,形成1molNH3需要形成3molN-H键,则形成3molN-H键放出的能量为3x,由N2和H2合成1molNH3时可放出ckJ,则反应的△H=a kJ•mol-1×$\frac{1}{2}$+b kJ•mol-1×$\frac{3}{2}$-3xkJ•mol-1=-ckJ•mol-1,解得:x=$\frac{(a+3b+2c)}{6}$kJ•mol-1,故选B.
点评 本题考查了键能与反应热的关系,题目难度中等,掌握反应热等于反应物的总键能减去生成物的总键能,注意总键能的计算.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
20.在氧化还原反应的过程中,氧化反应和还愿反应同时发生,有关SO2+2H2O→SO42-+4H++2e-反应的说法错误的是( )
| A. | 该反应为氧化反应 | |
| B. | 上述反应中若产生0.1 mol SO42-,则消耗SO2的物质的量为0.1mol | |
| C. | Fe2(SO4)3、品红两种溶液都能使上述反应进行 | |
| D. | 通入Cl2会降低SO2的漂白作用 |
1.释放能量的化学反应一定是( )
| A. | 断开反应物中化学键吸收的能量比形成生成物中化学键放出的能量大 | |
| B. | 断开旧键吸收的能量大于形成新键所放出的能量 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 反应物的总能量低于生成物的总能量 |
5.下列说法不正确的是( )
| A. | 凡是铵盐都能与苛性钠共热产生NH3 | |
| B. | NH4HCO3受热分解产生的气体经足量碱石灰干燥后可得到纯净的氨气 | |
| C. | N2与O2在放电条件下化合属于氮的固定 | |
| D. | 工业硝酸略显黄色是由于里面含有Fe3+的缘故 |
15.某无色溶液能与镁反应放出氢气,此溶液中可能大量共存的离子组是( )
| A. | Ca2+、H+、Cl-、CO32- | B. | K+、Cl-、SO42-、SO32- | ||
| C. | K+、OH-、SO32-、MnO4- | D. | H+、Al3+、Mg2+、Cl- |
2.0.1mol•L-1的下列物质的水溶液中,氢离子浓度最大的是( )
| A. | NH3•H2O | B. | NH4Cl | C. | HCl | D. | HCOOH |
19.请判断在下列物理变化过程中,化学键被破坏的是( )
| A. | 碘升华 | B. | 溴蒸气被木炭吸附 | ||
| C. | 葡萄糖在水中的扩散 | D. | 氯化钠晶体溶于水 |
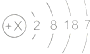 A、B、C、D、E为原子序数依次增大的五种短周期元素.已知:A、D同主族,且A元素原子的最外层电子数是次外层电子数的两倍;B元素为短周期是最活泼的金属元素;C元素阳离子C3+的电子层结构与Ne相同;元素E与右图原子结构示意图所对应元素M处于同一主族.根据要求回答下列问题.
A、B、C、D、E为原子序数依次增大的五种短周期元素.已知:A、D同主族,且A元素原子的最外层电子数是次外层电子数的两倍;B元素为短周期是最活泼的金属元素;C元素阳离子C3+的电子层结构与Ne相同;元素E与右图原子结构示意图所对应元素M处于同一主族.根据要求回答下列问题. .
.